2016-2017年高一上期化学期中考试在线测验(广东省广州市执信中学)
| 1. | 详细信息 |
|
关于物质的类别,下列说法正确的是( ) A.食盐水、糖水、冰水都属于混合物 B.烧碱、火碱、消石灰都属于碱 C.KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸 D.溶液、胶体、浊液都属于稳定的分散系 |
|
| 2. | 详细信息 |
|
下列选项中能表示阿伏伽德罗常数数值的是( ) A.1mol H+含有的电子数 B.标准状况下,22.4L酒精所含的分子数 C.1.6 g CH4 含有的质子数 D.1L 1mol/L的硫酸钠溶液所含的Na+ 数 |
|
| 3. | 详细信息 |
|
下列各物质所含原子数目,按由大到小顺序排列的是( ) ①0.5mol NH3②标准状况下22.4L He ③4℃9mL水 ④19.6g H3PO4 . A.①④③② B.④③②① C.②③④① D.①④②③ |
|
| 4. | 详细信息 |
|
FeCl3溶液和Fe(OH)3胶体共同具备的性质是( ) A.加入饱和NaCl溶液都产生沉淀 B.加入盐酸先产生沉淀,后沉淀溶解 C.分散质的粒子都能通过滤纸 D.都能产生丁达尔效应 |
|
| 5. | 详细信息 |
|
含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42?的物质的量浓度为( ) A.0.9 mol/L B.1.8 mol/L C.0.7mol/L D.0.5mol/L |
|
| 6. | 详细信息 |
|
用NA表示阿伏伽德罗常数的值,下列叙述不正确的是( ) A.标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA B.通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA C.常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl? 个数为0.4NA D.标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA |
|
| 7. | 详细信息 |
|
用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是( ) A.未冷却就转移、定容 B.容量瓶原有少量蒸馏水 C.定容时俯视刻度线观察液面 D.量筒取浓盐酸时,俯视读数 |
|
| 8. | 详细信息 |
|
下列化学方程式正确的是( ) A.Cu+2HCl?CuCl2+H2↑ B.Al2O3+3H2O?2Al(OH)3 C.Mg(OH)2 D.Ba(OH)2+SO2?BaSO4↓+H2O |
|
| 9. | 详细信息 |
|
在一定体积的容器中,加入1.5摩氙气和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气.则所得无色晶体产物中,氙与氟的原子个数比是( ) A.1:2 B.1:3 C.1:4 D.1:6 |
|
| 10. | 详细信息 |
|
下列事实与胶体性质有关的是( ) ①豆浆加入盐卤做豆腐 ②在河流入海口易形成沙洲 ③油水混合会分层④工厂采用静电除尘 ⑤CuSO4与NaOH溶液混合产生沉淀 ⑥血液透析. A.①②④⑥ B.①②③⑤ C.③④⑤⑥ D.全部 |
|
| 11. | 详细信息 |
|
下列分离提纯所选用的试剂正确的是( ) A.除去O2中混有的N2:选用灼热的铜网 B.提取碘水中的碘单质:选用有机试剂苯 C.除去CO2中混有的CO:选用适量澄清石灰水 D.除去Mg粉中混有的MgO:选用过量稀盐酸 |
|
| 12. | 详细信息 |
|
等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是( ) A.1:2:3 B.6:3:2 C.3:2:1 D.1:1:1 |
|
| 13. | 详细信息 |
|
下列说法正确的是( ) A.只含一种元素的物质一定是单质 B.只含一种分子的物质一定纯净物 C.非金属氧化物一定是酸性氧化物 D.有单质生成的反应一定是置换反应 |
|
| 14. | 详细信息 | |||||||||||||||
下列实验操作能达到实验目的是( )
|
||||||||||||||||
| 15. | 详细信息 |
|
某氯原子的质量是ag,12C原子的质量是b g,用NA表示阿伏伽德罗常数的值.下列说法正确的是( ) A.该氯原子的相对原子质量为 B.m g该氯原子的物质的量为 C.该氯原子的摩尔质量为aNAg D.a g该氯原子所含的电子数为17 mol |
|
| 16. | 详细信息 |
现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: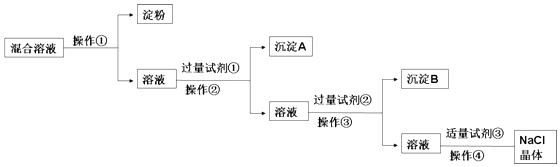 (1)操作①是利用胶体不能通过 而把淀粉胶体和溶液进行分离. (2)写出上述实验过程中所用试剂的化学式:试剂① ;试剂③ . (3)判断试剂①已过量的操作是: . (4)控制试剂③适量的方法是: . (5)试剂②的作用(用化学方程式表示): . |
|
| 17. | 详细信息 | ||||||
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: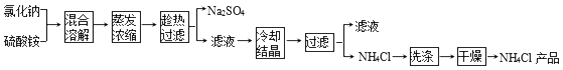 【查阅资料】 ①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:  请回答下列问题: (1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: . (2)欲制备10.7g NH4Cl,理论上需NaCl质量为 g. (3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 . (4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 . (5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
|
|||||||
| 18. | 详细信息 |
|
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙. 【查阅资料】 Ⅰ.金属Ca的部分性质有: ①常温或加热条件下Ca都能与氧气反应; ②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热; ③Ca+H2 Ⅱ.固体CaH2的部分性质有: ①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存. 【进行实验】 该小组同学设计的制取装置如图所示(固定装置略).  回答下列问题: (1)写出Ca常温遇水发生反应的化学方程式: . (2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 . (3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: . 【实验反思】 该小组同学通过反思提出问题:上述制得的CaH2是否纯净? 他们再次设计实验进行检验,实验步骤如下: 步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略). 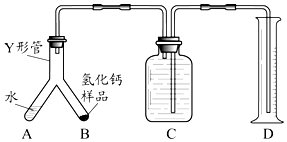 步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL. (4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的. |
|
| 19. | 详细信息 |
银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图: (注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃) (1)写出渣料与稀硫酸反应的化学方程式: . (2)固体混合物A的组成为 、 . (3)操作A的名称为 . (4)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2 , 至少需要1.0mol?L?1的Al2(SO4)3溶液 L. (5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥. |
|
最近更新



