2017-2018年高一12月月考化学在线测验(辽宁省大石桥市第二高级中学)
| 1. 选择题 | 详细信息 |
从化学试剂商店买来的无水乙醇试剂瓶上所贴的危险化学品标志是()    A. 腐蚀品 B. 爆炸品 C. 易燃液体 D. 剧毒品 |
|
| 2. 选择题 | 详细信息 |
|
下列物质的分类全部正确的是() A. CO 酸性氧化物CaO 碱性氧化物 B. 冰水混合物 混合物胆矾 纯净物 C. 烧碱 碱硫化氢 酸 D. NaHSO4 一元酸 BaSO4 强电解质 |
|
| 3. 选择题 | 详细信息 |
|
下列关于“焰色反应”的理解正确的是 A. 只有金属单质才有焰色反应 B. 只有金属化合物才有焰色反应 C. 只有某些金属或其化合物才有焰色反应 D. 只有金属离子才有焰色反应 |
|
| 4. 选择题 | 详细信息 |
|
下列关于金属元素特征的叙述中,正确的是 ①金属元素的原子只有还原性,离子只有氧化性 ②金属元素在化合物中都显正价 ③元素的金属性越强,相应的离子氧化性越弱 ④失电子数越多,元素的金属性越强. A. ①②③ B. ②③ C. ① D. 全部 |
|
| 5. 选择题 | 详细信息 |
|
下列各组溶液,能在强酸性或强碱性中都能大量共存且无色的离子组是 A. Cu2+、K+、CO32-、NH4+ B. Ba2-、Na+、SO42-、NO3- C. Na+、H+、HCO3-、Cl- D. K+、Na+、NO3-、SO42- |
|
| 6. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是() A. 氧化铜与稀硝酸反应:CuO + 2H+ B. 稀 H2SO4与铁粉反应:2Fe + 6H+ C. 盐酸滴在石灰石上:2H++ CO32? D. 硫酸氢钠与过量氢氧化钡反应:Ba2++2OH?+ 2H+ +SO42? |
|
| 7. 选择题 | 详细信息 |
|
现有以下物质:①NaCl晶体②液态HCl③CaCO3固体④熔融KCl⑤蔗糖⑥铜⑦CO2⑧H2SO4⑨KOH固体⑩浓盐酸.下列说法正确的是( ) A. 以上物质能导电的是④⑥⑩ B. 以上物质属于电解质的是①②③④⑧⑨⑩ C. 属于非电解质的是②⑤⑦ D. 以上物质中,溶于水能够导电的物质是①②④⑤⑦⑧⑩ |
|
| 8. 选择题 | 详细信息 |
|
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置.下列各图中能用作防倒吸安全瓶的是( ) A. 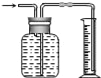 B. B. 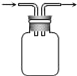 C. C.  D. D.  |
|
| 9. 选择题 | 详细信息 |
|
下列关于胶体的叙述中正确的是 A. 布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来 B. 分散质粒子直径大小介于1nm~10nm之间的微粒称为胶体粒子 C. 用平行光照射NaCl溶液和Fe(OH)3胶体时,均产生丁达尔效应 D. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
|
| 10. 选择题 | 详细信息 |
|
以NA表示阿伏加德罗常数的值,下列说法正确的是() ①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ②同温同压下,体积相同的氢气和氩气所含的分子数相等 ③1L 2mol/L的氯化镁溶液中含氯离子数目为4NA ④标准状况下,22.4L水中分子数为NA ⑤46g NO2和N2O4混合气体中含有原子数为3NA A. ①②③④ B. ③④ C. ①③ D. ①②③⑤ |
|
| 11. 选择题 | 详细信息 | |||||||||||||||
下列实验操作正确且能达到相应实验目的的是()
|
||||||||||||||||
| 12. 选择题 | 详细信息 |
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( ) A. A B. B C. C D. D |
|
| 13. 选择题 | 详细信息 |
|
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式与事实不相符的是( ) A. OH?+CO32?+2H+?HCO3?+H2O B. 2OH?+CO32?+3H+?HCO3?+2H2O C. OH?+CO32?+3H+?CO2↑+2H2O D. 2OH?+CO32?+4H+?CO2↑+3H2O |
|
| 14. 选择题 | 详细信息 |
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的( )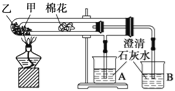 A. 甲为小苏打,乙为纯碱 B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 C. 加热不久就能看到A烧杯的澄清石灰水变浑浊 D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊 |
|
| 15. 选择题 | 详细信息 |
|
在一密闭容器中有HCHO、H2、O2 混合气体共20g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是() A. 40% B. 33% C. 60% D. 36% |
|
| 16. 选择题 | 详细信息 |
|
现有100ml 3mol/L的NaOH溶液和100ml1mol/L的AlCl3溶液。按以下两种方法进行实验: i)将NaOH溶液分多次加入到AlCl3溶液 ii)将AlCl3溶液分多次加入到NaOH溶液中。比较两次实验的结果是:() A. 现象相同,最终得到沉淀的质量相等 B. 现象不同,最终得到沉淀的质量相等 C. 现象相同,最终得到沉淀的质量不相等 D. 现象不同,最终得到沉淀的质量不相等 |
|
| 17. 选择题 | 详细信息 |
|
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( ) A. Na2CO3和Na2O2 B. Na2CO3和NaOH C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3 |
|
| 18. 选择题 | 详细信息 |
|
标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( ) A. c= |
|
| 19. 选择题 | 详细信息 |
在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( ) A. 1:1 B. 1:3 C. 3:1 D. 2:1 |
|
| 20. 选择题 | 详细信息 |
|
现有盐酸和硫酸混合溶液200mL,其中c(Cl-)=0.6mol/L,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生4.66g白色沉淀,往另一份中投入足量铁片,放出标准状况下VL气体。下列判断正确的是 A. V=1.12 B. 原混合酸中 c(H2SO4)=0.1mol/L C. 原混合酸中c(H+)=2mol/L D. 另一份溶液中消耗铁5.6g |
|
| 21. 综合题 | 详细信息 |
Ⅰ.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置. (1)写出下列仪器的名称:a.__ b.__; (2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母); (3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__. (4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸. II.(5)现需配制0.1mol?L?1NaOH溶液480mL,根据此,回答下列问题: ①配制氢氧化钠溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和__. ②实验时需要称量氢氧化钠__g; ③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)__. A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中 D.将容量瓶盖紧,上下颠倒摇匀 E.改用胶头滴管加水,使溶液凹面恰好与刻度相切 F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处 ④配制0.1mol?L?1NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有__(填写字母). A.称量时用了生锈的砝码 B.未洗涤溶解NaOH的烧杯 C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D.容量瓶未干燥即用来配制溶液 E.定容时仰视刻度线 F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线. |
|
| 22. 填空题 | 详细信息 | ||||
|
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2 (1)该反应中的还原剂是____________。 (2)该反应中,发生还原反应的过程是______________→____________。 (3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。 (4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。 (5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
|
|||||
| 23. 推断题 | 详细信息 |
|
有1L的无色溶液可能含有阳离子是K+、Cu2+、Ca2+,含有的阴离子可能Cl?、CO32-、SO42- 现做以下实验: ①取50ml的溶液在大烧杯中加入中,向溶液中加入过量的BaCl2溶液振荡,有白色沉淀生成;过滤,干燥,烘干后得4.30g固体 ②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过滤干燥后称量得到2.33g ③取少量①实验后上层清液滴入AgNO3溶液,有白色沉淀生成。 (1)根据上述实验现象,判断原溶液中肯定不含有______________,一定含有______________可能含有____________,请设计方案证明:_______________________。 (2)写出一定发生的离子方程式:_______________________,___________________,__________________。 (3)若经证明没有Cl?则该溶液中的K+的物质的量浓度是:_____________________。 |
|
| 24. 计算题 | 详细信息 |
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示: (1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________; (2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol; (3)A点对应的数值为_______; (4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。 (5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。 |
|
最近更新



