2017-2018年高一12月月考化学考试(湖北省宜昌市长阳县第一高级中学)
| 1. | 详细信息 |
|
钠露置在空气中,其变质过程中不可能产生的物质是 A. Na2O B. Na2CO3 C. NaOH D. NaHCO3 |
|
| 2. | 详细信息 |
|
对下列物质进行的分类正确的是 A. CuSO4?5H2O属于纯净物 B. 凡能电离出H+的化合物均属于酸 C. 纯碱、烧碱、碱石灰均属于碱 D. 盐类物质一定含有金属元素 |
|
| 3. 选择题 | 详细信息 |
|
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中 A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④ |
|
| 4. | 详细信息 |
|
下列说法正确的是 A. 液态HCl、固体NaCl都不导电,所以HCl、NaCl均是非电解质 B. 胶体带电,溶液呈电中性 C. 氧化铝是一种耐火材料,但不可用氧化铝坩埚熔化氢氧化钠、碳酸钠的固体 D. 铁容易生锈,而铝在空气中较稳定,所以铁比铝活泼 |
|
| 5. | 详细信息 |
|
下列各组离子一定能大量共存的是 A. 在含大量Fe3+的溶液中:NH4+、Na+、Cl―、SCN― B. 在强碱溶液中:Na+、K+、AlO2―、CO32― C. 能与Al反应放出氢气的溶液中:NH4+、Al3+、SO42―、NO3― D. 在无色透明溶液中:K+、Fe2+、Cl―、NO3― |
|
| 6. | 详细信息 |
|
下列物质中①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 ⑤Al(OH)3中,既能与盐酸反应,又能与氢氧化钠溶液反应的物质是 A. ①②③⑤ B. ①④⑤ C. ②③⑤ D. ①③④ |
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是 A. 铝粉投入到NaOH溶液中:2Al+2OH-?2AlO2-+3H2↑ B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ?Al(OH)3↓ C. 三氯化铁溶液中加入铁粉: D. FeCl2溶液跟Cl2反应:2Fe2++Cl2?2Fe3++2Cl- |
|
| 8. | 详细信息 |
|
将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( ) A. 3?2 B. 2?3 C. 1?2 D. 1?1 |
|
| 9. 选择题 | 详细信息 |
下列操作中选择的仪器正确的是:①分离汽油和氯化钠溶液? ②从含Fe3+的自来水中到蒸馏水③分离氯化钾和二氧化锰混合物? ④从氯化钠溶液中得到氯化钠晶体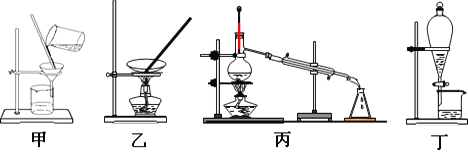 A. ①-丁 ②-丙 ③-甲 ④-乙 B. ①-乙 ②-丙 ③-甲? ④-丁 C. ①-丁 ②-丙 ③-乙 ④-甲 D. ①-丙 ②-乙 ③-丁? ④-甲 |
|
| 10. | 详细信息 |
如图所示,若锥形瓶内是水,分液漏斗内的液体是盐酸,向烧杯内滴加少量盐酸时,发现U形管内液体右移,静止冷却后液面左边低于右边,则烧杯内的物质不可能是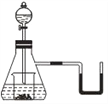 A. 过氧化钠 B. 碳酸氢钠 C. 氧化钠 D. 铝 |
|
| 11. 选择题 | 详细信息 |
|
用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为 A. 等于1.12L B. 等于0.56L C. 大于1.12L D. 小于1.12L |
|
| 12. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数,下列叙述正确的是 A. 1molFe在1molCl2中充分燃烧,转移的电子数目为3NA B. 2.3gNa和足量O2完全反应,在常温或燃烧时,转移电子数均为NA C. 在常温常压下,14g由N2和CO组成的混合气体含有的原子数目为NA D. 20℃、101KPa,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA |
|
| 13. | 详细信息 |
|
下列六种质物中,不能与CO2反应的是 ①Na2O? ②Na2O2? ③CaCl2溶液? ④Na2CO3溶液 ⑤NaOH溶液? ⑥NaHCO3溶液 A. ③⑥ B. ③④ C. ②③ D. ②⑤ |
|
| 14. 选择题 | 详细信息 |
|
某溶液中含有HCO3-、CO32-、Na+、NO3- 四种离子,若向其中加入Na2O2粉末,充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是 A. NO3- B. CO32-、NO3- C. CO32- D. CO32-、NO3-、Na+ |
|
| 15. | 详细信息 |
|
下列两种无色试剂,不能通过互滴观察现象进行鉴别的是 A. NaHCO3、HCl B. Na2CO3 、HCl C. NaAlO2 、H2SO4 D. AlCl3 、NaOH |
|
| 16. | 详细信息 |
|
下列说法正确的是 A. 溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素 B. 除去CO2中的HCl气体,只需将气体通过NaOH溶液 C. 在某溶液中滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO D. 在氧化还原反应中,阳离子也能失去电子被氧化,阴离子也能得到电子被还原 |
|
| 17. | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol?L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( ) A. 11.2g B. 5.6g C. 2.8g D. 1.4g |
|
| 18. 填空题 | 详细信息 |
|
(1)碱洗铝材除其表面的氧化膜,反应的离子方程式为________________,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示),该反应中的氧化剂是___________。 (2)除去碳酸钠固体中的碳酸氢钠杂质,发生反应的化学方程式为_________________________。 |
|
| 19. 推断题 | 详细信息 | |||||||||||||||
|
A、B、C、D四种溶液,它们的阳离子分别是K+、Na+、Ba2+、Cu2+中的某一种,阴离子分别是OH-、CO32-、NO3-、Cl-的某一种(都不重复),现进行如下实验: ①B溶液中加入铁粉,溶液质量减少; ②A、C溶液分别滴加AgNO3溶液时均产生白色沉淀,再加稀硝酸,只有A产生的白色沉淀溶解,且冒气泡; ③A的焰色反应为紫色(透过蓝色钴玻璃 ) ④C、D分别加稀硫酸时只有C 产生白色沉淀,D无现象; 由上述现象可推知各种溶液中所含的阴阳离子,把符号填写在下表中:
|
||||||||||||||||
| 20. 综合题 | 详细信息 |
|
X、Y、Z、W四种化合物均由原子序数小于18的元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答: ? 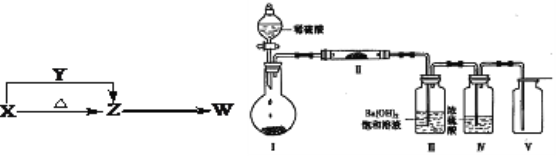 (1)W的化学式是______________。 (2)X与Y在溶液中反应的离子方程式是_________________________________。 (3)某实验小组利用上图装置(夹持固定装置已略去)进行实验,装置Ⅰ中为X,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。 ①装置Ⅰ中反应的化学方程式是__________________________________,装置Ⅱ中主要的化学反应方程式是__________________________________。 ②Ⅱ中的物质中阳离子与阴离子个数比是______。 |
|
| 21. 推断题 | 详细信息 |
已知有以下物质相互转化,A是生活中用量最大的金属。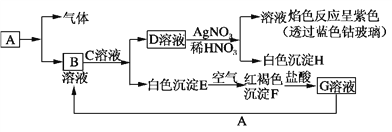 试回答: (1)写出C的化学式________,H的化学式________。 (2)写出由E转变成F的化学方程式____________________________________。 (3)检验G溶液中的金属阳离子的方法是________________________________。 (4)写出A在一定条件下与水反应的化学方程式_______________________________________。 |
|
| 22. 实验题 | 详细信息 |
|
现有一定量含有Na2O杂质的Na2O2样品,请设计实验测定该样品的纯度。可供选择的装置如图: ? 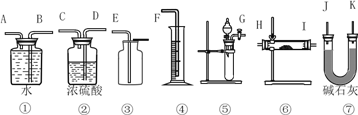 (1)选用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,选择的仪器组合是____________。 A.①②④⑤ B.①④⑤ C.⑤⑥⑦ D.①③⑤⑦ (2)实验中选用装置的连接顺序是_________________(填各接口的字母,连接胶管省略)。 (3)写出实验中Na2O2发生反应的化学方程式,并用双线桥标注电子转移的方向和数目__________。若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为168mL(标准状况),则Na2O2试样的纯度为_________。 (4)向紫色石蕊试液中加入Na2O2粉末,振荡,正确的叙述是________。 A.最后溶液变蓝 B.溶液先变蓝后褪色 C.溶液仍为紫色 D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生 |
|
最近更新



