甘肃2019年高三化学上学期月考测验免费检测试卷
| 1. | 详细信息 |
|
下列关于古籍中的记载说法不正确的是( ) A. 《抱朴子》中“丹砂烧之成水银,积变又还成丹砂”两个反应互为可逆反应 B. 《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 C. 《本草纲目》中“以火烧之,紫青烟起,乃真硝石”利用焰色反应区分硝石(KNO3)和朴硝(Na2SO4) D. 汉朝的《淮南万毕术》《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆能化铁为铜”都是指铜可以采用湿法冶炼。 |
|
| 2. | 详细信息 |
|
阿伏加德罗常数的值为NA.下列说法正确的是( ) A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA B. 5.6gFe与稀H2SO4完全反应,转移的电子数为0.3NA C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
|
| 3. | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A. CuSO4溶液和氢硫酸反应:Cu2++S2-=CuS↓ B. NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- C. 向FeBr2溶液中通入等量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- D. 稀硫酸与氢氧化钡溶液反应:H+ + OH-+SO42-+ Ba2+= BaSO4↓ + H2O |
|
| 4. | 详细信息 |
|
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应: ①SO2+2Fe3++2H2O===SO42-+2Fe 2++4H+; ②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。 下列有关说法不正确的是( ) A. SO2发生氧化反应 B. 若有13.44 L SO2(标准状况)参加反应,则最终消耗0.4mol K2Cr2O7 C. 氧化性:SO42- < Fe3+ < Cr2O72- D. 每0.2 mol K2Cr2O7参加反应,转移电子的数目为1.2NA |
|
| 5. | 详细信息 |
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是 A. 观察Fe(OH)2的生成 B. 除去CO中的CO2 C. 配制一定物质的量浓度的NaNO3溶液 D. 25 mL滴定管读数为11.80 mL |
|
| 6. | 详细信息 |
|
有以下六种饱和溶液①CaCl2;②Ca(OH)2;③Na2SiO3;④Na2CO3;⑤NaAlO2;分别持续通入CO2,最终不会得到沉淀或析出晶体的是( ) A. ④⑤ B. ③⑤ C. ①④ D. ①② |
|
| 7. | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是( ) A. NaCl B. Cu C. Fe2O3 D. MgCO3 |
|
| 8. | 详细信息 | ||||||||||||
下列实验与对应示意图的关系正确的是( )
|
|||||||||||||
| 9. | 详细信息 |
|
下列有关溶液组成的描述合理的是( ) A. 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- B. 弱碱性溶液中可能大量存在Na+、 K+、Cl-、HCO3- C. pH=1的溶液中可能大量存在Na+、NH4+、SiO32-、I- D. 0.1 mol·L-1NaAlO2溶液中可能大量存在Na+、H+、 Cl-、SO42- |
|
| 10. | 详细信息 |
|
现有浓度均为1 mol·L-1的FeCl3、CuCl2、FeCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。下列有关叙述不正确的是( ) A. 反应后的溶液中含有0.2 mol Fe2+和0.1 mol Cu2+ B. 反应后的溶液中含有Fe2+、Cu2+,不含Fe3+ C. 反应后的溶液中Fe2+的浓度增至3 mol·L-1 D. 反应后残留固体为3.2 g |
|
| 11. | 详细信息 | |||||||||||||||
下列实验方案能达到实验目的的是
|
||||||||||||||||
| 12. | 详细信息 |
|
一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( ) A. 450mL B. 150mL C. 200mL D. 无法计算 |
|
| 13. | 详细信息 |
|
铜的冶炼过程大致可分为: ①富集,将硫化物矿进行浮选;②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2↑;④电解精炼铜.下列说法正确的是( ) A. 冶炼过程中的尾气可用来制硫酸 B. 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 C. 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 D. 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
|
| 14. | 详细信息 |
|
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( ) A. 取a g混合物充分加热,减重b g B. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体 C. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体 D. 取a g混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b g |
|
| 15. | 详细信息 |
|
下列说法中不正确的有( ) ①铝制餐具不宜用来蒸煮或长时间存放酸性、碱性的食物 ②Al2O3熔点高,可用于制作耐高温仪器 ③SiO2有导电性,可用于制备光导纤维 ④二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 ⑤金属活动性不同,冶炼方法也有所不同 ⑥明矾常作为饮用水的消毒剂 ⑦镁铝合金的强度和硬度都比纯铝和纯镁大 ⑧除去铜器表面铜绿而不损伤器物,可用稀硝酸 A. ①③⑤⑥ B. ②⑥⑦⑧ C. ③④⑥⑧ D. ④⑤⑦⑧ |
|
| 16. | 详细信息 |
含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( ) A. 该过程中可得到化工产品H2SO4 B. 该过程中化合价发生改变的元素为Fe和S C. 该工艺流程是除去煤燃烧时产生的SO2 D. 图中涉及的反应之一为Fe2(SO4)3+SO2 + 2H2O=2FeSO4+2H2SO4 |
|
| 17. | 详细信息 |
|
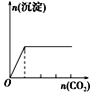
有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验: ①用pH试纸检验,溶液呈强酸性。 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。 ③该溶液的焰色反应没有黄色; ④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。  (1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。 (2)肯定不含的离子是_________________________________。 (3)不能确定的离子是_________,如何证明该离子是否存在?__________。 (4)请写出沉淀溶解过程的离子方程式____________________________。 |
|
| 18. | 详细信息 |
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。 (1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 ①检验滤液B中是否还含有铁元素的方法为:_______________(注明试剂、现象)。 ②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(填代号)。 a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳 ③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边___________________(填操作名称)、过滤、洗涤。 ④高铁酸钠(Na2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与漂白液(主要成分NaClO)在强碱性条件下反应可制取Na 2FeO4,反应的离子方程式为___________________________。 (2) ①SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______________(填代号)。  ②过量CO2通入到硅酸钠的溶液中,然后加热蒸干,再高温灼烧,最后所得固体成分___________。 |
|
| 19. | 详细信息 |
某学习小组通过查阅资料得知,CO2与Na2O2的反应需要在一定量水蒸气存在的条件下才能进行,于是他们设计了如图所示的装置对此问题进行探究,同时验证Na2O2与CO2反应的气体产物。 (1)写出装置A中有关反应的离子方程式:_________________,装置B中的试剂是____,装置E的作用是_____________。 (2)U形管C中的试剂是____。若要求根据装置D中的现象来确定CO2与Na2O2之间的反应是否需要在潮湿的条件下才能进行,对两个止水夹的操作方式为先打开K1,关闭K2,D中无明显现象;当打开K2,关闭K1,D中的现象为 ______________,则说明反应需要在潮湿条件下进行。 (3)检验气体产物的方法:用玻璃片在水里盖住集气瓶口,将集气瓶从水中取出,正放在实验台上,_______________。 (4)有人认为,经过较长时间反应后,装置D中生成的物质只有Na2CO3而没有NaOH。请设计一个方案证明此结论是正确的:______________。 |
|
| 20. | 详细信息 | |||||||||||||||
活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下: 已知各相关氢氧化物沉淀pH范围如下表所示:
|
||||||||||||||||