2018至2019年高二下半年期中考试化学考试完整版(吉林省吉林市第五十五中学)
| 1. 选择题 | 详细信息 |
|
下列元素性质的递变规律正确的是 A. 第一电离能:B<Be<Mg<Na B. 元素的电负性:O>N>S>P C. 气态氢化物的稳定性:NH3<CH4<PH3<SiH4 D. 原子半径:Be<B<C<N |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A.同一原子中,2p、3p、4p能级的轨道数依次增多 B.电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 C. D.在离核最近区域内运动的电子能量最低 |
|
| 3. 选择题 | 详细信息 | ||||||||||||
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ/mol)。
|
|||||||||||||
| 4. 选择题 | 详细信息 |
|
下列化学用语的表述不正确的是 A. 过氧化氢的结构式:H—O—O—H B. 氮原子的L层电子轨道表示式:  C. CO2的比例模型: D. Cl-的结构示意图: |
|
| 5. 选择题 | 详细信息 |
|
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是 A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 D.根据较强酸可以制取较弱酸的规律,推出 |
|
| 6. 选择题 | 详细信息 |
|
以下有关元素性质的说法不正确的是 A. 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是① B. 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4第一电离能最大的是③ C. ①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D. 某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+ |
|
| 7. 选择题 | 详细信息 |
|
下列组合中,属于含有极性键的非极性分子的是 A.C2H4、C2H2、CO2 B.CH4、CHCl3、CO2 C.Cl2、H2、N2 D.NH3、H2O、CO2 |
|
| 8. 选择题 | 详细信息 |
|
下列分子中,中心原子杂化轨道类型相同,分子的空间构型也相同的是 A.BeCl2、CO2B.H2O、SO2C.SO2、CH4D.NF3、CH2O |
|
| 9. 选择题 | 详细信息 |
|
下列物质中只含有非极性共价键的是( ) A. Cl2 B. NaOH C. KCl D. H2S |
|
| 10. 选择题 | 详细信息 |
|
下列叙述中正确的是 A.冰融化时水分子中共价键发生断裂 B.H2O2、PCl5都是含有极性键的非极性分子 C.HF、HCl、HBr、HI的酸性依次增强 D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
|
| 11. 选择题 | 详细信息 |
|
对下列化学用语的理解和描述均正确的是 A. 电子式 B. 填充模型 C. 原子结构示意图 D. 结构示意图为 |
|
| 12. 选择题 | 详细信息 |
|
关于晶体的下列说法正确的是 A. 任何晶体中,若含有阳离子就一定有阴离子 B. 原子晶体中只含有共价键 C. 原子晶体的熔点一定比金属晶体的高 D. 离子晶体中只含有离子键,不含有共价键 |
|
| 13. 选择题 | 详细信息 |
|
下列物质固态时,一定是分子晶体的是( ) A. 酸性氧化物 B. 非金属单质 C. 碱性氧化物 D. 含氧酸 |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是() A. 1molNa2O2晶体中阴离子与阳离子之比为1:1 B. 1molSi晶体中含4molSi—Si键 C. 60gSiO2中含Si—O键的个数为4NA D. 12 g金刚石中含有C—C键的个数为NA |
|
| 15. 选择题 | 详细信息 |
|
氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的粒子间的作用与氮化硅熔化所克服的粒子间的作用相同的是 A.硝石(NaNO3)和金刚石 B.晶体硅和水晶 C.重晶石(BaSO4)和萤石(CaF2) D.冰和干冰 |
|
| 16. 选择题 | 详细信息 |
|
能够解释 CO2 比 SiO2的熔、沸点低的原因是 A. CO2 的相对分子质量比 SiO2 的相对分子质量小 B. C﹣O 键能小于 Si﹣O 键能 C. C 的原子半径小于 Si D. 破坏 CO2 晶体只需克服分子间作用力,破坏 SiO2 晶体要破坏 Si﹣O 共价键 |
|
| 17. 选择题 | 详细信息 |
钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )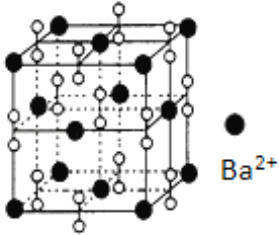 A. 该晶体属于离子晶体 B. 晶体的化学式为Ba2O2 C. 该晶体晶胞结构与NaCl相似 D. 与每个Ba2+距离相等且最近的Ba2+共有12个 |
|
| 18. 综合题 | 详细信息 |
|
东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①[Ni(NH3)6]SO4中阴离子的立体构型是__________。 ②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。 ③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是___________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。 (3)单质铜及镍都是由________键形成的晶体。 |
|
| 19. 综合题 | 详细信息 | ||||||||||||||||||||
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
|
|||||||||||||||||||||
| 20. 填空题 | 详细信息 |
|
[化学——选修3:物质结构与性质] 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题: (1)Zn原子核外电子排布式为________________。 (2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。 (3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。 (4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。  |
|
最近更新




