2018年至2019年高二上学期第一次月考化学试卷带参考答案和解析(宁夏回族自治区育才中学)
| 1. | 详细信息 |
能源分类相关图如图所示,下列四个选项中,全部符合图中阴影部分的能源是( )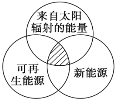 A. 煤炭、石油、沼气 B. 水能、生物质能、天然气 C. 太阳能、风能、潮汐能 D. 地热能、海洋能、核能 |
|
| 2. | 详细信息 |
下列物质间的反应,其能量变化符合下图的是( )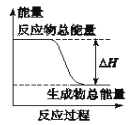 A.由 Zn 和稀 H2SO4反应制取氢气 B.灼热的碳与二氧化碳反应 C. Ba(OH)2•8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解 |
|
| 3. | 详细信息 |
|
下列说法中正确的是( ) A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化 B. 破坏生成物全部化学健所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 C. 生成物的总焓大于反应物的总焓时,反应吸热,△H>0 D. △H的大小与热化学方程式的化学计量数无关 |
|
| 4. | 详细信息 |
|
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则关于方程式2H2O(l)===2H2(g)+O2(g)的ΔH的说法中正确的是( ) A. 方程式中的化学计量数表示分子数 B. 该反应ΔH大于零 C. 该反应ΔH=-571.6 kJ/mol D. 方程式中的化学计量数扩大一倍ΔH不变 |
|
| 5. | 详细信息 |
|
在同温同压下,下列各组热化学方程式中,△H2>△H1的是 A. 2H2(g)+O2(g)=2H2O(g) △H1; 2H2(g)+O2(g)=2H2O(l) △H2 B. S(s)+O2(g)=SO2(g) △H1; S(g)+O2(g)=SO2(g) △H2 C. C(s)+ 1/2O2(g)=CO(g) △H1; C(s)+O2(g)=CO2(g) △H2 D. H2(g)+Cl2(g)=2HCl(g) △H1; 1/2 H2(g)+ 1/2 Cl2(g)=HCl(g) △H2 |
|
| 6. | 详细信息 |
|
某反应的△H=+100kJ/mol,下列有关该反应的叙述正确的是( ) A. 正反应活化能小于100kJ/mol B. 逆反应活化能一定小于100kJ/mol C. 正反应活化能可能等于100kJ/mol D. 正反应活化能比逆反应活化能大100kJ/mol |
|
| 7. | 详细信息 |
依据如图判断,下列说法正确的是( )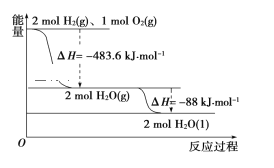 A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1 B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低 C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
|
| 8. | 详细信息 |
|
已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( ) A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ |
|
| 9. | 详细信息 |
298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )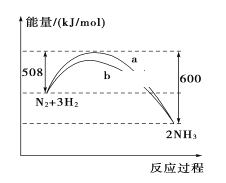 A. 加入催化剂,不能改变该化学反应的反应热 B. b曲线是加入催化剂时的能量变化曲线 C. 该反应的热化学方程式为:N2(g)+3H2(g) D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ |
|
| 10. | 详细信息 |
|
已知CH4(g)和CO(g)的燃烧热分别是890.3 kJ·mol-1和 283.0kJ·mol-1,则由CH4(g)不完全燃烧生成1 mol CO(g)和H2O(l)的ΔH为( ) A. -607.3 kJ·mol-1 B. +607.3 kJ·mol-1 C. -324.3 kJ·mol-1 D. +324.3 kJ·mol-1 |
|
| 11. | 详细信息 |
|
下列有关热化学方程式的叙述中,正确的是( ) A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1 B. 已知热化学方程式:SO2(g)+ C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1 D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定 |
|
| 12. | 详细信息 |
|
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为 A. -1780kJ/mol B. -1220 kJ/mol C. -450 kJ/mol D. +430 kJ/mol |
|
| 13. | 详细信息 |
|
对于可逆反应A(g)+3B(s) A. υ(A)=0.3mol/(L·min) B. υ(B)=0.6mol/(L·min) C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min) |
|
| 14. | 详细信息 |
|
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) A. a的值为2 B. 平衡时X的浓度为0.2 mol·L-1 C. Y的转化率为60% D. 反应速率v(Y)=0.3 mol·(L·min)-1 |
|
| 15. | 详细信息 | |||||||||||||||||||||||||
实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
|
||||||||||||||||||||||||||
| 16. | 详细信息 |
|
在C(s)+CO2(g) ①升高温度 ②增加碳的量 ③恒容通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥恒容通入CO A.①③④ B.②④⑥ C.①③⑥ D.③⑤⑥ |
|
| 17. | 详细信息 |
已知:CO2(g)+3H2(g) A. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 B. 从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1 C. 13min时,向容器中充入2 mol氦气,该反应的化学反应速率增加 D. 13min时,向容器中充入2 mol氦气,CO2的转化率增加 |
|
| 18. | 详细信息 |
|
在一定温度下,向一个容积为2 L的真空容器内(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间反应后,测得容器内的压强为起始时的0.9倍。在此时间内H2的平均反应速率为0.1 mol/(L·min),则此反应所经过的时间为 A. 2 min B. 3 min C. 4 min D. 5 min |
|
| 19. | 详细信息 |
|
下列说法正确的是( ) A. 升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C. 增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 D. 催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 |
|
| 20. | 详细信息 |
|
下列关于化学反应速率的说法正确的是( ) A. 恒温时,增大压强,化学反应速率一定加快 B. 其他条件不变,温度越高,化学反应速率越快 C. 使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量 D. 3mol·L-1·s-1的反应速率一定比1mol·L-1·s-1的反应速率大 |
|
| 21. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是( ) A. 对于2HI(g) B. 已知, N2 (g) + 3 H2(g) C. 反应CO(g)+NO2(g) D. 溴水中有下列平衡Br2+H2O |
|
| 22. | 详细信息 |
|
可以作为判断化学平衡发生移动的标志是( ) A. 反应混合物各组分的浓度发生改变 B. 正、逆反应速率发生改变 C. 反应物的转化率发生改变 D. 反应混合物的浓度发生改变 |
|
| 23. | 详细信息 |
|
一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g) ①X、Y、Z的密度不再发生变化 ②v正(Y)= 2v逆(X) ③容器中的压强不再发生变化 ④单位时间内生成nmol Z,同时生成2nmolY A. ①② B. ①④ C. ②③ D. ③④ |
|
| 24. | 详细信息 | ||||||||||||||||
t℃时,在体积不变的容器中发生反应X(g)+3Y(g)
|
|||||||||||||||||
| 25. | 详细信息 |
|
在一密闭容器中,aA(g) A. a>b B. 物质A的转化率减小了 C. 物质B的质量分数不变 D. 平衡向正反应方向移动了 |
|
| 26. | 详细信息 |
|
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) A. x=1 B. B的转化率为20% C. 平衡时A的浓度为1.50 mol/L D. B的平均反应速率为0.2 mol/(L·s) |
|
| 27. | 详细信息 |
|
硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列四种情况中最早出现浑浊的是( ) A. 10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL B. 10℃时0.1 mol /LNa2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL C. 20℃时0.1 mol /LNa2S2O3和0.1 mol /LH2SO4各 5 mL D. 20℃ 时0.2mol /L Na2S2O3和0.1 mol /LH2SO4各5 mL,加水10 mL |
|
| 28. | 详细信息 |
|
化学反应C(s)+H2O(g) A. 扩大容器的容积,平衡向正反应方向移动 B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 C. 加入水蒸气使容器压强增大,平衡向逆反应方向移动 D. 加入固体碳,平衡向正反应方向移动 |
|
| 29. | 详细信息 |
|
对恒温恒容密闭容器中的可逆反应:A(g)+3B(g) A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大 B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大 C. 增大A的浓度,v(正)会增大,但v(逆)会减小 D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同 |
|
| 30. | 详细信息 |
|
氢气是一种理想的绿色能源。 (1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题: ①氢气的燃烧热为________________ ②该反应的热化学方程式为_____________________ (2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________kJ·mol-1。 |
|
| 31. | 详细信息 | ||||||||||||||||||||||||||||||
|
某实验小组用0.50mol·L-1 氢氧化钠溶液和0.50mol·L-1硫酸溶液进行中和热的测定。 (1)倒入NaOH溶液的正确操作是_______________(从下列选出)。 A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入 (2)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。 A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动 (3)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:近似认为0.50 mol·L-1 氢氧化钠溶液和0.50 mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。
|
|||||||||||||||||||||||||||||||
| 32. | 详细信息 |
(10分)、反应A(g)+B(g)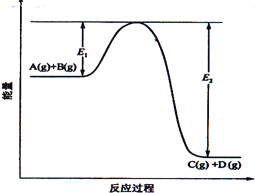 (1)该反应是____________________反应(填“吸热”“放热”); (2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是_______________________________; (3)反应体系中加入催化剂对反应热是否有影响?________,原因是_________: (4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。 |
|
| 33. | 详细信息 |
有一化学反应aA+bB=C,根据影响化学反应速率的因素可得v(C)=kcm(A)cn(B)。其中k是与温度有关的常数,为测k、m、n的值,在298 K时,将A、B溶液按不同的浓度混合,得到下列实验数据: (1)根据上表可求得:m=_______,n=______,k=________。 (2) 当c(A)=c(B)=2.0mol/L时,用B表示的初始反应速率为___________________。 |
|
高中化学 试卷推荐
最近更新



