2017福建高一下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
随着社会的进步和人民生活水平的提高,环境问题越来越受到人们的关注。下列名词中与环境问题无关的是( ) ①温室效应 ②赤潮 ③酸雨 ④光化学烟雾 ⑤臭氧空洞 ⑥潮汐 ⑦富营养化 ⑧白色污染 A.②⑥⑦ B.⑥ C.①③⑤ D.⑥⑦⑧
|
|
| 2. | 详细信息 |
|
取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是( ) A.加入盐酸,产生白色沉淀,则试样中一定有Ag+ B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- C.加入BaCl2溶液,产生白色沉淀,加入稀硝酸,沉淀不溶解,试样中一定有SO42- D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+
|
|
| 3. | 详细信息 |
|
分离NaCl和NH4Cl的最佳方法是( ) A.利用溶解度不同,采用结晶法 B.加入烧碱 C.直接加热法 D.加入AgNO3溶液
|
|
| 4. | 详细信息 |
|
区别浓硫酸和稀硫酸,既简单又可靠的方法是( ) A.各取少许溶液分别放铜片 B.分别与石蕊试液作用 C.用玻璃棒各蘸取少许涂在纸上 D.各取少许溶液分别放入铝片
|
|
| 5. | 详细信息 |
|
NO2可以用氢氧化钠溶液吸收,或在一定条件下用氨气与其反应使之转化为无污染的物质,发生反应的化学方程式分别是:2NO2+2NaOH===M+NaNO3+H2O,8NH3+6NO2===7X+12H2O。则M、X代表的物质的化学式分别是( ) A.NaNO2、N2 B.HNO2、N2 C.NO、HNO3 D.N2、N2
|
|
| 6. | 详细信息 |
|
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在 盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内 鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试 管内完全被充满,原来试管中盛装的气体是( ) A.可能是N2和NO2的混合气体 B.一定是NO2气体 C.一定是NO与NO2的混合气体 D.可能是NO2一种气体
|
|
| 7. | 详细信息 |
|
下列属于铵盐的共同性质的是( ) A.都是晶体,都易溶于水 B.铵盐受热均可分解生成NH3 C.铵盐都能与碱反应,不能与酸反应 D.所有铵盐中,氮元素化合价都是-3价
|
|
| 8. | 详细信息 |
|
检验SO2中是否混有CO2气体,可采用的方法是( ) A.通过品红溶液,若品红溶液褪色,则说明混有CO2气体 B.通过澄清石灰水,若变浑浊,则说明混有CO2气体 C.先通过足量NaOH溶液, D.先通过足量酸性KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变浑浊,则说明混有CO2气体
|
|
| 9. | 详细信息 |
|
将质量相同的四份Cu粉,分别置于过量的下列酸里,产生气体的物质的量最多的是( ) A.稀H2SO4 B.浓H2SO4 C.稀HNO3 D.浓HNO3
|
|
| 10. | 详细信息 |
|
除去下列物质中混有的少量杂质(括号中的物质)采用的操作方法,错误的是( ) A.N2(NO2)通过水洗气 B.NO(NH3)通过浓硫酸洗气 C.N2(O2)通过灼热的铜粉 D.NH4Cl溶液(I2)用CCl4萃取分液
|
|
| 11. | 详细信息 |
|
在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,并加热,被还原的硫酸为0.9 mol。则浓H2SO4的实际体积为( ) A.等于50 mL B.大于50 mL C.等于100 mL D.大于100 mL
|
|
| 12. | 详细信息 |
|
下列气体中易液化,遇挥发性酸时冒白烟,宜作致冷剂的是( ) A.N2 B.NH3 C.NO D.NO2
|
|
| 13. | 详细信息 |
|
已知某溶液中存在较多的H+、SO42+ 、NO3- ,则溶液中还可能大量存在的离子组成( ) A.Al3+、CH3COO-、Cl- B.Na+、NH4+、Cl- C.Mg2+、Cl-、Fe2+ D.Mg2+、Ba2+、Br-
|
|
| 14. | 详细信息 |
|
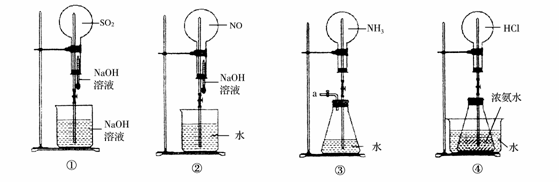
如下图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
|
|
| 15. | 详细信息 |
|
.不能由单质直接化合而制得的物质有( ) A.SO2 B.SO3 C.H2S D.HC1
|
|
| 16. | 详细信息 |
|
.1640年,我国早期科技丛书《物理小识·金石类》记有“青矾厂气熏人,衣服当之易烂,载木不盛”。“青矾”强热,得赤色固体,“气”凝即得“矾油”。 “矾油”是指( ) A.硝酸 B.氨水 C.硫酸 D.盐酸
|
|
| 17. | 详细信息 |
|
在周期表中金属和非金属的分界线附近能找到( ) A.制农药的元素 B.制催化剂的元素 C.做半导体的元素 D.制耐高
|
|
| 18. | 详细信息 |
|
四种主族元素的离子 ①a-b=m-n ②元素的原子序数a> b>c>d ③元素非金属性Z > R ④最高价氧化物对应水化物的碱性X > Y A.②③ B.③ C.①③④ D.①②③
|
|
| 19. | 详细信息 |
|
下列关于元素周期表的叙述,错误的是( ) A.镁是第IIA族元素 B.第IA族元素全部是金属元素 C.O族中无金属元素 D.第3周期中既有金属元素又有非金属元素
|
|
| 20. | 详细信息 |
|
.下列说法中正确的是( ) A.将SO2通入BaCl2溶液中至饱和,无沉淀产生;再通入Cl2,产生沉淀 B.98%以上的浓硝酸在空气中会产生白烟,所以叫发烟硝酸 C.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 D.医学上用碳酸钡作为钡餐
|
|
| 21. | 详细信息 |
|
钾和钠的性质相似,下列说法中能较好地解释这个事实的是( )
C.原子半径相差不大 D.最高化合价相同
|
|
| 22. | 详细信息 |
|
.足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与2.24 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( ) A.100 mL B.80 mL C.60 mL D.40 mL
|
|
| 23. | 详细信息 |
|
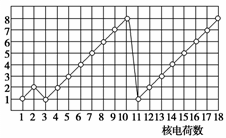
下图表示1~18号元素(原子)的结构或性质随核电荷数递增的变化。 该图中,纵坐标表示 A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
|
|
| 24. | 详细信息 |
|
今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( ) A.硅原子和钠原子 B.硼原子和氢原子 C.氮原子和碳原子 D.碳原子和铝原子
|
|
| 25. | 详细信息 |
|
下列分子中所有原子的最外层均为8电子结构的是( ) A.BeCl2 B.H2S C.NCl3 D.SF6
|
|
| 26. | 详细信息 |
|
. A.HX B.H2X C.XH3 D.XH4
|
|
| 27. | 详细信息 |
|
下列有关性质的比较,不能用元素周期律解释的是( ) A.非金属性:Cl > Br B.酸性:HCl> H2S C.碱性:KOH > NaOH D.热稳定性:NH3 > PH3
|
|
| 28. | 详细信息 |
|
下列反应起了氮的固定作用的是( ) A.N2和H2在一定条件下反应生成NH3 B.NH3经催化氧化生成NO C.NO和O2反应生成NO2 D.由NH3制碳铵或氯铵
|
|
| 29. | 详细信息 |
|
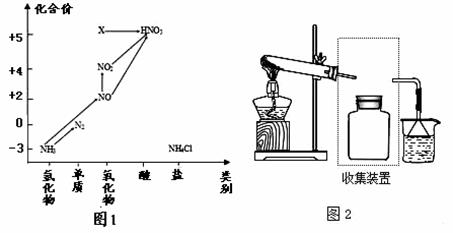
依据图1中氮元素及其化合物的转化关系,回答问题:
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________________. (2)收集氨气的方法是________ _ (3)下列试剂不能用于干燥NH3的是_ _. A.碱石灰 B.无水CaCl2 C.NaOH固体 (4)工业上以NH3、空气、水为原料生产硝酸分为三步: ①NH3→NO化学方程式为__ . ②NO→NO2实验现象是_ _. ③NO2 +H2O→HNO3氧化剂与还原剂物质的量之比为__ . (5)将X转化为HNO3_ _(填“是”或“不是”)氧化还原反应. (6)若要将NH3→N2,从原理上看,下列试剂可行的是__ . A.O2 B.Na C.NH4Cl D.NO2. (7)标准状况下,将500L氨气溶与水形成1L氨水,则此氨水的物质的量浓度为______mol/L (保留三位有效数字)。该氨水最多能吸收SO2的体积为 .
|
|
| 30. | 详细信息 |
|
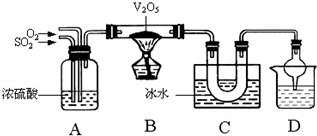
我 Ⅱ.已知SO3熔点16.83℃、沸点44.8℃.某兴趣小组利用SO2和O2在催化剂V2O5的 (2)写出B中催化剂V2O5表面所发生的反应的化学方程式:_____ _. 可能为______. (5)接触法生产H2SO4的过程中,对废气、废液、废 ④将“废热”通过“废热”锅炉产生蒸气发电. A.只有①② B.只有①③④ Ⅲ、在下列用途或反应中,硫酸表现出的性质为:A.高沸点;B.强酸;C.吸水性;D.脱水性;E.强氧化性。试用字母填空:
|
|
| 31. | 详细信息 |
|
元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)写出⑦元素名称_____,画出⑥的离子结构示意图__________; 写出② (2)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序 (3)②③⑥元素氢化物的稳定性由强到弱的顺序为________ (填化学式)。 (4)表中能形成两性氢氧化物的元素是_______ (填元素符号) (5)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应____________________________________. (6)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由 ________
|
|