2017云南高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列物质中,属于天然高分子化合物的是 A.麦芽糖 B.纤维素 C.油脂 D.氨基酸
|
|
| 2. | 详细信息 |
|
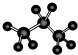
下列化学用语正确的是 ①质子数为53,中子数为78的碘原子: ③硫离子结构示意图: ⑤苯的结构式: ⑦丙烷分子的球棍模型: A.①③⑤⑥⑦⑧ B.①②③④⑦ C.①⑦⑧ D.①③⑤⑥⑦
|
|
| 3. | 详细信息 |
|
现有以下物质:①NaCl溶液;②干冰;③冰醋酸(纯净的醋酸);④铜;⑤BaSO4固体;⑥蔗糖;⑦酒精;⑧熔融的KNO3其中属于电解质的是 A.①③⑤⑧ B.②③
|
|
| 4. | 详细信息 | ||||||||||||||||||||
|
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
|
|||||||||||||||||||||
| 5. | 详细信息 | ||||||||||||||||||||
|
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
|
|||||||||||||||||||||
| 6. | 详细信息 |
|
下列各组金属的 A.. Ca、Mg B.Al、Fe C.Hg、Ag D..Fe、Cu
|
|
| 7. | 详细信息 |
|
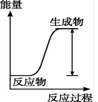
下列反应中的能量变化与右图相符的是
B.乙醇燃烧 C.中和反应 D.铝热法炼铁
|
|
| 8. | 详细信息 |
|
往浅绿色的Fe(NO3)2溶液中逐滴加入稀硫酸后,溶液的颜色 A.逐渐变浅 B.变深绿色 C.变黄色 D.没有变化
|
|
| 9. | 详细信息 |
|
只用试管和胶头滴 A.KOH溶液和AlCl3溶液 B.Na2CO3溶液和HC C.MgCl2溶液和氨水
|
|
| 10. | 详细信息 |
|
下列说法正确的是: A.用酸性KMnO4溶液可以检验绿矾(FeSO4·7H2O)是否部分变质 B.加热法不可以分离I2和NH4Cl固体混合物 C.氢氧化铁胶体具有很强的吸附性,可用于除去水中的所有杂质 D.分别向2支试管中加入相同体积不同
|
|
| 11. | 详细信息 |
|
下面关于Na2C A.水中的溶解度:Na2CO3<NaHCO3 B.往Na2CO3和NaHCO3溶液中滴加酚酞都变红,说明Na2CO3和NaHCO3都是碱 C.NaHCO3能转化 D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,放出的CO2的物质的量相等
|
|
| 12. | 详细信息 |
|
下列说法或做法错误的是 ①将SO2通入KMnO4酸性溶液中证明SO2的水溶液具有漂白性 ②二氧化硫的排放是造成光化学烟雾的主要因素 ③某无色溶液中加Ba(NO3)2溶液有白色沉淀生成,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- ④稀释浓硫酸,将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失 ⑤SO2使溴水褪色后,将褪色溶液加热,溶 A.②④⑤ B.①②③ C.②③④ D.全部
|
|
| 13. | 详细信息 | |||||||||||||||
|
下列选项中能发生反应,且甲组为取代反应,乙组为加成反应的是
|
||||||||||||||||
| 14. | 详细信息 |
|
从海带中提取碘单质,成熟的工艺流程如下,下列关于海带提碘的说法,正确的是
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B.操作②可用乙醇替代CCl4 C.操作③为蒸馏 D.含I-的滤液中加入稀硫酸和H2O2后,碘元素发生还原反应
|
|
| 15. | 详细信息 |
|
某无色溶液中含有大量的H+和SO42-,则此溶液还能大量存在的离子组是 A. Na+、Fe2+、NO3- B.Na+、Mg2+、NO3- C. Cr2O72-、Ba2+、Cl- D.K+、Na+、SO32-
|
|
| 16. | 详细信息 |
|
下列离子方程式中,书写不正确的是 A.金属钾与水反应:2K+2H2O=2K++2OH-+2H2↑ B.氯气通入碘化钾溶液中:Cl2 + 2I-= 2Cl- + I2 C.铜片放入稀硝酸中:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O D.醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+ H2O+CO2↑
|
|
| 17. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.1molCH4分子中共价键总数为4NA B.18 g D2O中含有的质子数目为10NA C.标准状况下,5.6 LCCl4含有的分子数为0.25NA D.28 g N2和1mol CH2=CH2所含电子数都是14NA
|
|
| 18. | 详细信息 | ||||||||
|
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,
A.阴离子还原性:W > Q B.X的最低价氢化物能形成分子间氢键 C.Z能在自然界中以游离态存在 D.Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA
|
|||||||||
| 19. | 详细信息 |
|
可逆反应:2NO2(g) ①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
|
|
| 20. | 详细信息 |
|
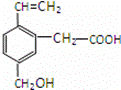
某有机物的结构如图所示,它不可能具有的性质是
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应 A.①
|
|
| 21. | 详细信息 |
|
.铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 下列有关该电池的说法不正确的是 A. 电池的电解液为碱性溶液,正极为Ni2O3、负极 B. 电池放电时,负极反应为Fe+2OH-—2e-=Fe(OH)2 C. 电池放电过程中,阴离子向负极移动 D. 电池放电时,正极发生氧化反应
|
|
| 22. | 详细信息 |
|
短周期元素T、Q、R、W、G在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
(1)用化学方程式表示工业上常用于冶炼T单质的原理:______________________。 (2)R的最高价氧化物的水化物的稀溶液与Cu反应的化学方程式为 。 (3)元素的非金属性:Q_____W(填“>”、“<”或“=”),结合方程式阐述其原因:__________________________________。 (4)W的氧化物与G的单质的水溶液均有漂白性,相同条件下,相同体积的M的氧化物与Y 的单质混合通入品红溶液,品红溶液_____(填“褪色”或“不褪色”),原因是__________(用化学方程式表示)。 (5)元素A与W同主族,位于W的下一周期,其原子结构示意图为 。
|
|
| 23. | 详细信息 |
|
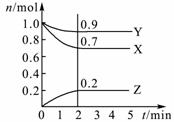
Ⅰ.某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
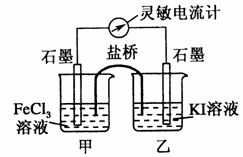
(1)该反应的化学方程式为 。 (2)反应开始至2 min,用Y表示的平均反应速率为 mol/L·min,X的转化率为 。 (3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是 。 A.X、Y、Z的浓度相等 B.X、Y、Z的分子数比为3︰1︰2 C.Z的生成速率是Y的生成速率的二倍 D.单位时间内生成n mol Y,同时生成3n mol X Ⅱ.根据如下图的原电池装置,完成下列内容
(4)该装置左池为 极,电极反应式为 。 (5)过一段时间后往右池中滴加淀粉溶液,现象是 。
|
|
| 24. | 详细信息 |
|
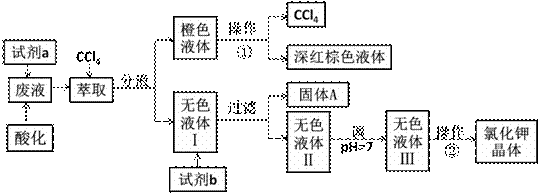
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供选择的试剂:①饱和Na2CO3溶液;②饱和K2CO3溶液;③KOH溶液;④BaCl2溶液;⑤Ba(NO3)2溶液;⑥H2O2溶液;⑦KMnO4溶液(H+);⑧稀盐酸。 请根据流程图,回答相关问题: (1)试剂a应该选用__________(填试剂编号),反应的离子方程式为 。 (2)萃取操作中,可以选的试剂还可以是 。 A. 裂化汽油 B.乙醇 C.苯 D.直馏汽油 (3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是__________。(填试剂序号) (4)调节pH的作用是___________________________________。 (5)操作①的名称是 ,操作②中用到的硅酸盐仪器除酒精灯、玻璃棒外还有________。
|
|
| 25. | 详细信息 |
|
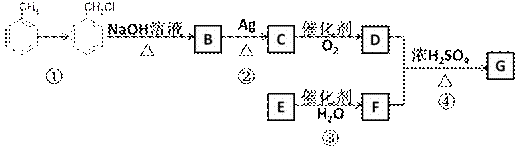
某有机物的合成路线如下,完成下列内容
已知:①R—Cl (1)反应①的反应物(除甲苯外)及反应条件为 。 (2)B中所含官能团名称为 。 (3)反应②的化学方程式为 。简述验证是有C生成的操作及现象 。 (4)反应③的化学方程式为 ,反应类型为 。 (5)反应④的化学方程式为 ,反应类型为 。
|
|