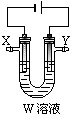2017йҷ•иҘҝй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺзӨҫдјҡгҖҒз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В ) В AпјҺжҳҺзҹҫгҖҒжјӮзҷҪзІүгҖҒиҮӯж°§зҡ„еҮҖж°ҙеҺҹзҗҶзӣёеҗҢ В BпјҺз”ЁйёЎиӣӢеЈіиҶңе’Ңи’ёйҰҸж°ҙйҷӨеҺ»ж·ҖзІүиғ¶дҪ“дёӯзҡ„йЈҹзӣҗдёҚж¶үеҸҠеҢ–еӯҰеҸҳеҢ– В CпјҺз…Өзҡ„е№ІйҰҸе’ҢзҹіжІ№зҡ„еҲҶйҰҸйғҪеұһдәҺзү©зҗҶеҸҳеҢ– В DпјҺдәҡзЎқй…ёй’ жҳҜдёҖз§ҚйЈҹе“ҒйҳІи…җеүӮпјҢдҪҝз”Ёж—¶е…¶з”ЁйҮҸеҸҜд»ҘдёҚеҠ йҷҗеҲ¶
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
OгҖҒSiгҖҒAlжҳҜең°еЈідёӯеҗ«йҮҸ В AпјҺз”өи§ЈAl2O3е’ҢSiO2пјҲе°‘йҮҸпјүзҡ„ж··еҗҲзү©пјҢеҸҜд»ҘеҲ¶еҫ—иҫғзәҜеҮҖзҡ„AlпјҢдё”жңүж°§ж°”з”ҹжҲҗ В BпјҺд»Һжө·ж°ҙдёӯеҲ¶еӨҮNaгҖҒMgгҖҒAlгҖҒClеӣӣз§Қе…ғзҙ еҚ•иҙЁзҡ„еҸҚеә”йғҪжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” В CпјҺжҷ®йҖҡзҺ»з’ғгҖҒж°ҙжіҘжҲҗеҲҶдёӯйғҪеҗ«жңүOгҖҒSiгҖҒAlдёүз§Қе…ғзҙ В DпјҺеҠ зғӯи’ёе№ІNaClгҖҒMgCl2жә¶ж¶Іж—¶еҸҜд»Ҙеҫ—еҲ°жҷ¶дҪ“NaClгҖҒMgCl2
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
д»…з”ЁжҸҗдҫӣзҡ„зЎ…й…ёзӣҗд»ӘеҷЁпјҲйқһзЎ…й…ёзӣҗд»ӘеҷЁд»»йҖүпјүпјҢдёҚиғҪиҫҫеҲ°зӣёеә”е®һйӘҢзӣ®зҡ„зҡ„жҳҜ(В В ) В AпјҺжҸҗзәҜзІ—зӣҗпјҡзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒжјҸж–—гҖҒй…’зІҫзҒҜгҖҒи’ёеҸ‘зҡҝ В BпјҺйҷӨеҺ»CO2ж°”дҪ“дёӯж··жңүзҡ„зҡ„е°‘йҮҸHClпјҡеҜјз®ЎгҖҒжҙ—气瓶 В CпјҺз”ЁCCl4жҸҗеҸ–зўҳж°ҙдёӯзҡ„зўҳпјҡеҲҶж¶ІжјҸж–—гҖҒзғ§жқҜ В DпјҺз”Ё18.4 molВ·L-1жө“зЎ«й…ёй…ҚеҲ¶100mL 1.0 molВ·L-1зЎ«й…ёпјҡ50mLйҮҸзӯ’гҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒ100mLе®№йҮҸ瓶гҖҒиғ¶еӨҙж»ҙз®Ў
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В ) AпјҺ0.1molдёҷзғҜй…ёдёӯеҗ«жңүеҸҢй”®зҡ„ж•°зӣ®дёә0.1NA BпјҺ1mol/L FeCl3жә¶ж¶ІдёӯпјҢйҳҙгҖҒйҳізҰ»еӯҗжҖ»ж•°еӨ§дәҺ0.4NA CпјҺ12gйҮ‘еҲҡзҹідёӯжүҖеҗ«зҡ„CвҖ”Cй”®ж•°дёә2NA DпјҺ18gзҡ„D2OдёҺNAдёӘCH3пјҚе…·жңүзӣёеҗҢзҡ„з”өеӯҗж•°
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ(В В ) гҖҖAпјҺжҠҠMgзІүж”ҫе…ҘFeCl3жә¶ж¶Ідёӯ: 2Fe3++ 3Mg+ 6H2O= 2Fe(OH)3вҶ“+3 Mg2++3H2вҶ‘ В BпјҺз”ЁжјӮзҷҪзІүжә¶ж¶Іеҗёж”¶е°ҫж°”дёӯSO2пјҡCa2+пјӢ2ClO-пјӢSO2пјӢH2OпјқCaSO3вҶ“пјӢ2HClO гҖҖCпјҺж°ҜеҢ–й“қжә¶ж¶ІдёӯеҠ е…ҘеҒҸй“қй…ёй’ жә¶ж¶ІпјҡAl3+ +3AlO2- +6H2O= 4Al(OH)3 вҶ“ В DпјҺзўій…ёж°ўй’ҷжә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҡCa2++2HCO3-+2OH-=CaCO3вҶ“+2H2O+CO32пјҚ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢеңЁжә¶ж¶ІдёӯеҸҜд»ҘеҸ‘з”ҹеҸҚеә”пјҡX+2Y3+=2Y2++X2+пјҢеҲҷдёӢеҲ—еҸҷиҝ°в‘ Xиў«ж°§еҢ–пјӣв‘ЎXжҳҜж°§еҢ–еүӮпјӣв‘ўY2+ж—ўе…·жңүж°§еҢ–жҖ§д№ҹе…·жңүиҝҳеҺҹжҖ§пјӣв‘ЈY2+жҳҜж°§еҢ–дә§зү©пјӣв‘ӨY3+зҡ„ж°§еҢ–жҖ§жҜ”X2+зҡ„ж°§еҢ–жҖ§ејәгҖӮд»ҘдёӢеҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(В В ) В AпјҺв‘ в‘Ўв‘ӨВ В В В В BпјҺв‘ в‘ўв‘ӨВ В В
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
зҫҺеӣҪ科еӯҰ家жҲҗеҠҹејҖеҸ‘дҫҝжҗәејҸеӣәдҪ“ж°§еҢ–зү©зҮғж–ҷз”өжұ пјҢе®ғд»Ҙдёҷзғ·ж°”дҪ“дёәзҮғж–ҷпјҢжҜҸеЎ«е……дёҖж¬ЎзҮғж–ҷпјҢеӨ§зәҰеҸҜиҝһз»ӯ24е°Ҹж—¶иҫ“еҮә50Wзҡ„з”өеҠӣгҖӮдёҖжһҒйҖҡе…Ҙз©әж°”пјҢеҸҰдёҖжһҒйҖҡе…Ҙдёҷзғ·ж°”дҪ“пјҢз”өи§ЈиҙЁжҳҜеӣәжҖҒж°§еҢ–зү©пјҢеңЁзҶ”иһҚзҠ¶жҖҒдёӢиғҪдј еҜјO2пјҚпјҢдёӢеҲ—еҜ№иҜҘзҮғж–ҷз”өжұ зҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В ) В AпјҺеңЁзҶ”иһҚз”өи§ЈиҙЁдёӯпјҢO2пјҚз”ұжӯЈжһҒ移еҗ‘иҙҹжһҒ В BпјҺиҜҘз”өжұ зҡ„жҖ»еҸҚеә”жҳҜпјҡC3H8+5O2вҶ’3CO2+4H2O В CпјҺйҖҡдёҷзғ·зҡ„з”өжһҒдёәз”өжұ иҙҹжһҒпјҢеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”дёәпјҡC3H8пјҚ20eпјҚ+10O2пјҚ=3CO2+4H2O В DпјҺз”өи·ҜдёӯжҜҸжөҒиҝҮ10 molз”өеӯҗпјҢжңү11.2 Lдёҷзғ·иў«е®Ңе…Ёж°§еҢ–
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡRCH2OH жҹҗжңүжңәзү©Xзҡ„еҢ–еӯҰејҸдёәC6H14OпјҢиғҪе’Ңй’ еҸҚеә”ж”ҫеҮәж°ўж°”гҖӮXз»Ҹй…ёжҖ§йҮҚ铬酸й’ҫ(K2Cr2O7)жә¶ж¶Іж°§еҢ–жңҖз»Ҳз”ҹжҲҗYпјҲC6H12O2пјү, иӢҘдёҚиҖғиҷ‘з«ӢдҪ“з»“жһ„гҖӮXе’ҢYеңЁдёҖе®ҡжқЎд»¶дёӢз”ҹжҲҗй…ҜжңҖеӨҡжңү(В В ) В В AпјҺ4з§ҚВ В В В В В В BпјҺ8з§ҚВ В В В В В CпјҺ32з§ҚВ В В В В В DпјҺ64з§Қ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺз”өи§ЈиҙЁжә¶ж¶Ізҡ„еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ(В В ) В AпјҺpHпјқ11зҡ„NaOHжә¶ж¶ІдёҺpHпјқ3зҡ„йҶӢй…ёжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢж»ҙе…Ҙзҹіи•Ҡжә¶ж¶Іе‘Ҳзҙ«иүІ В BпјҺеңЁpH=3 зҡ„жә¶ж¶ІдёӯпјҢNa+гҖҒCl-гҖҒFe2+гҖҒClO-дёҚиғҪеӨ§йҮҸе…ұеӯҳ В CпјҺеёёжё©дёӢпјҢpH=7зҡ„NH4ClдёҺж°Ёж°ҙзҡ„ж··еҗҲжә¶ В DпјҺеҗ‘0.1molВ·LпјҚ1зҡ„ж°Ёж°ҙдёӯеҠ е…Ҙе°‘йҮҸзЎ«й…ёй“өеӣәдҪ“пјҢеҲҷжә¶ж¶Ідёӯc(OHпјҚ)/c(NH3В·H2O)еҮҸе°Ҹ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
зҰ»еӯҗжЈҖйӘҢзҡ„еёёз”Ёж–№жі•жңүдёүз§Қпјҡ
дёӢеҲ—зҰ»еӯҗжЈҖйӘҢзҡ„ж–№жі•дёҚеҗҲзҗҶзҡ„жҳҜ(В В ) В AпјҺNH4пјӢпјҚж°”дҪ“жі•В В В В В В В В BпјҺIпјҚпјҚжІүж·Җжі•В В CпјҺNa+пјҚжҳҫиүІжі•В В В В В В В В В В В DпјҺCO32- пјҚж°”дҪ“жі•е’ҢжІүж·Җжі•
|
|||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖдәӣжІ»ж„ҹеҶ’зҡ„иҚҜзү©еҗ«жңүPPAжҲҗеҲҶпјҢPPAеҜ№ж„ҹеҶ’жңүжҜ”иҫғеҘҪзҡ„еҜ№з—Үз–—ж•ҲпјҢдҪҶд№ҹжңүиҫғеӨ§зҡ„еүҜдҪңз”ЁпјҢ2000е№ҙ11жңҲпјҢжҲ‘еӣҪиҚҜзӣ‘еұҖзҙ§жҖҘйҖҡзҹҘпјҢеҒңжӯўдҪҝз”Ёеҗ«жңүPPAжҲҗеҲҶзҡ„ж„ҹеҶ’иҚҜпјҢPPAжҳҜзӣҗй…ёиӢҜдёҷйҶҮиғәпјҲphengВ propanolamineзҡ„зј©еҶҷпјүпјҢд»Һе…¶еҗҚз§°зңӢпјҢе…ідәҺе…¶жңүжңәжҲҗеҲҶзҡ„еҲҶеӯҗз»“жһ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В ) В A.еҸҜиғҪеҗ«вҖ”OHгҖҒвҖ”C6H5В В В В В В В В В В В B.дёҖе®ҡеҗ«вҖ”OHгҖҒвҖ”C6H5гҖҒвҖ”NH2 В C.еҸҜиғҪвҖ”C6H5гҖҒвҖ”COOHВ В В В В В В В D. дёҖе®ҡеҗ«вҖ”COOHгҖҒвҖ”C6H5гҖҒвҖ”NH2
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёжҹҗз§Қд»ӘеҷЁйҮҸдёҖж¶ІдҪ“дҪ“з§Ҝж—¶пјҢе№іи§ҶиҜ»ж•°дёәV1mLпјҢд»°и§ҶиҜ»ж•°дёәV2mLпјҢдҝҜи§ҶиҜ»ж•°дёәV3mLпјҢиӢҘV2>V1> V3пјҢеҲҷжүҖдҪҝз”Ёд»ӘеҷЁеҸҜиғҪжҳҜ(В В ) В AпјҺе®№йҮҸ瓶    BпјҺйҮҸзӯ’В В CпјҺзўұејҸж»ҙе®ҡз®ЎВ В DпјҺд»ҘдёҠд»Ә
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—еҗ„з»„зү©иҙЁдёӯпјҢдёҚжҳҜжҢү
|
|||||||||||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸ–nВ gжҹҗзү©иҙЁеңЁж°§ж°” В A. H2е’ҢCOзҡ„ж··еҗҲж°”В В В В B. C2H2O2В В В В В В В В В C. C3H6O3В В В D. C6H12O5
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжқЎд»¶дёӢпјҢеҸҜйҖҶеҸҚеә”XпјҲgпјүпјӢ3YпјҲgпјү В A.c1пјҡc2пјқ1пјҡ3В В В В В В В В В В В В В В В В В В В В В В В В В В B.XгҖҒYзҡ„иҪ¬еҢ–зҺҮдёҚзӣёзӯү В C.е№іиЎЎж—¶пјҢYе’ҢZзҡ„з”ҹжҲҗйҖҹзҺҮд№ӢжҜ”дёә3пјҡ2В В В D.c1зҡ„еҸ–еҖјиҢғеӣҙдёә0< c1<0.14 mo /L
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
еҸҚеә”йҖҹзҺҮVе’ҢеҸҚеә”зү©жө“еәҰзҡ„е…ізі»жҳҜз”Ёе®һйӘҢзҡ„ж–№жі•жөӢе®ҡзҡ„пјҢеҢ–еӯҰеҸҚеә”пјҡH2+Cl2=2HClзҡ„еҸҚеә”йҖҹзҺҮVеҸҜд»ҘиЎЁзӨәдёәпјҡv=kВ·CmпјҲH2пјүВ·CnпјҲCl2пјүпјҢејҸдёӯзҡ„kдёәеёёж•°пјҢmе’Ңnзҡ„еҖјд»ҘеҸҜз”ЁдёӢеҲ—иЎЁдёӯж•°жҚ®зЎ®е®ҡд№ӢгҖӮ
з”ұжӯӨеҸҜд»ҘжҺЁеҫ—пјҢmе’Ңnзҡ„еҖјжӯЈзЎ®зҡ„жҳҜ(В В ) В AпјҺm=1пјҢn=2В В BпјҺ m=
|
|||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶAlCl3е’ҢNaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢеҫ—еҲ°зҡ„жІүж·Җзү©дёӯй“қе…ғзҙ зҡ„иҙЁйҮҸдёҺжә¶ж¶ІдёӯжүҖеҗ«й“қе…ғзҙ зҡ„иҙЁйҮҸзӣёзӯүпјҢеҺҹAlCl3жә¶ж¶Іе’ҢNaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰд№ӢжҜ”еҸҜиғҪжҳҜ(В В ) В A. 1пјҡ3В В В B. 1пјҡ4В В В C. 2пјҡ5 В В D. 2пјҡ7
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
жҹҗеӯҰз”ҹз”ЁNaHCO3е’ҢKHCO3з»„жҲҗзҡ„жҹҗж··еҗҲзү©иҝӣиЎҢе®һйӘҢпјҢжөӢеҫ—еҰӮдёӢж•°жҚ®пјҲзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүпјүпјҢдёӢеҲ—еҲҶжһҗжҺЁзҗҶжӯЈзЎ®зҡ„жҳҜ(В В )
В AпјҺзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә5.0 molВ·LпјҚ1 В BпјҺж №жҚ®иЎЁдёӯж•°жҚ®и®Ўз®—еҮәж··еҗҲзү©дёӯNaHCO3зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә50% В CпјҺ9.2gж··еҗҲзү©дёӯNaHCO3е’ҢKHCO3еҲҶеҲ«дёә5.0 gе’Ң4.2g В DпјҺ15.7gж··еҗҲзү©жҒ°еҘҪдёҺзӣҗй…ёе®Ңе…ЁеҸҚеә”
|
|||||||||||||
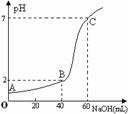
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
В AпјҺжүҖз”ЁHClзҡ„жө“еәҰжҳҜ0.09molВ·Lв”Җ1пјҢNaOHжә¶ж¶Іжө“еәҰдёә0.03molВ·Lв”Җ1 В BпјҺеңЁBзӮ№пјҢжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰе…ізі»дёәпјҡc(Clв”Җ)пјһc(H+)пјһc(Na+)пјһc(OHв”Җ) В CпјҺAгҖҒBгҖҒCдёүзӮ№з”ұж°ҙзҡ„з”ө В DпјҺж»ҙе®ҡеүҚпјҢй”ҘеҪўз“¶з”Ёеҫ…жөӢж¶Іж¶Ұжҙ—пјҢеҜјиҮҙHClжө“еәҰеҒҸдҪҺ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІйҖҸжҳҺжә¶ж¶ІдёӯпјҢз”ұж°ҙз”өзҰ»еҮәжқҘзҡ„c(H+)=1Г—10-3mol/LпјҢеңЁиҜҘжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨҹеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(В В ) В AпјҺK+гҖҒNa+гҖҒSO42-гҖҒNO3-В В В В В В В В В В В В BпјҺFe3+гҖҒA13+гҖҒCl-гҖҒHS- В CпјҺNa+гҖҒA1O2-гҖҒNa+гҖҒHCO3-В В В В В В В В В В В В В В В В В В В DпјҺK+гҖҒNa+гҖҒMnO4-гҖҒNO3-В В В В
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ | |||
|
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFе…ӯз§ҚеҢ–еҗҲзү©пјҢе…¶дёӯAгҖҒBгҖҒCгҖҒDгҖҒEеқҮз”ұзҹӯе‘Ёжңҹе…ғзҙ з»„жҲҗпјҢз„°иүІеҸҚеә”еқҮдёәй»„иүІпјҢBгҖҒCгҖҒEеқҮз”ұдёүз§Қе…ғзҙ з»„жҲҗгҖӮBгҖҒCзҡ„з»„жҲҗе…ғзҙ зӣёеҗҢпјҢдё”Cзҡ„ж‘©е°”иҙЁйҮҸжҜ”BеӨ§80g/mol пјҢеӣһзӯ”пјҡ В В (1).еӣәдҪ“еҢ–еҗҲзү©Aдёәжө…й»„иүІзІүжң«пјҢиҜҘеҢ–еҗҲзү©дёӯеҗ«жңүзҡ„еҢ–еӯҰй”®дёәВ В В В В В В В В В В В В В В В AгҖҒзҰ»еӯҗй”®В В В В BгҖҒ В В (2).дёӢиЎЁдёәBдёҺFе®һйӘҢзҡ„йғЁеҲҶеҶ…е®№
еҶҷеҮәBдёҺзЁҖH2SO4еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В еҶҷеҮәв‘ЎдёӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (3).зҺ°з”ұ6з§ҚзІ’еӯҗMn2+гҖҒMnO4-гҖҒH+гҖҒH2OгҖҒX2Y82-пјҲCдёӯеҗ«жңүзҡ„йҳҙзҰ»еӯҗпјүпјҢXY42-е®ҢжҲҗдёҖдёӘзҰ»еӯҗж–№зЁӢејҸпјҢе·ІзҹҘMn2+дёәиҝҳеҺҹеүӮпјҢеҫ—еҲ°1mol MnO4-йңҖж°§еҢ–еүӮзҡ„зү©иҙЁзҡ„йҮҸдёәВ В В В В В В В В В mol В (4). еҠ зғӯеҲ°е®Ңе…ЁеҸҚеә”еҗҺпјҢж°”дҪ“дә§зү©йҖҡиҝҮжө“H2SO4еўһйҮҚ3.42gпјҢеү©дҪҷж°”дҪ“йҖҡиҝҮзўұзҹізҒ°еўһйҮҚ2.20gпјҢеҲҷж··еҗҲзү©дёӯDзҡ„иҙЁйҮҸдёәВ В В В В В В В В gпјҢE В·
|
||||
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
в… .жҜ”иҫғеҲҶжһҗжҳҜеҢ–еӯҰеӯҰд№ дёӯйҮҚиҰҒзҡ„еӯҰд№ ж–№жі•пјҢд№ҹжҳҜжҲ‘们еӯҰд№ дёӯи§ЈеҶій—®йўҳзҡ„йҮҚиҰҒжҖқжғі.жҹҗеҗҢеӯҰеңЁиҝӣиЎҢй•Ғй“қжҖ§иҙЁе®һйӘҢж—¶пјҢеҸ‘зҺ°з”Ёй“қеҲҶеҲ«дёҺHпјӢжө“еәҰзӣёеҗҢзҡ„зЁҖзЎ«й…ёе’ҢзЁҖзӣҗй…ёеҸҚеә”ж—¶пјҢе®һйӘҢзҺ°иұЎжҳҺжҳҫдёҚеҗҢпјҢеңЁй“қдёҺзЎ«й…ёеҸҚеә”дёӯпјҢдә§з”ҹзҡ„ж°”жіЎеҫҲе°‘пјҢд»ҺеҸҚеә”жң¬иҙЁзңӢпјҢдёӨиҖ…зҡ„е®һйӘҢзҺ°иұЎеә”иҜҘзӣёеҗҢпјҢеңЁдёҚиҖғиҷ‘е®һйӘҢжқЎд»¶гҖҒж“ҚдҪңе’ҢиҚҜе“ҒзәҜеәҰзҡ„жғ…еҶөдёӢпјҢиҜ·дҪ еҜ№дә§з”ҹдёҠиҝ°зҺ°иұЎзҡ„еҺҹеӣ жҸҗеҮәеҒҮи®ҫпјҢ并и®ҫи®ЎдёҖз®ҖеҚ•зҡ„е®һйӘҢжқҘйӘҢиҜҒдҪ зҡ„еҒҮи®ҫгҖӮдҪ зҡ„еҒҮи®ҫжҳҜВ В В В В В В В В В В В В В В В В В В В В В В пјҢе®һ в…Ў.д»ҘдёӢжҳҜи‘—еҗҚзҡ„зўҳж—¶й’ҹе®һйӘҢ В е·ІзҹҘеңЁй…ёжҖ§жә¶ж¶ІдёӯпјҢзўҳй…ёй’ҫе’ҢдәҡзЎ«й…ёй’ дјҡеҸ‘з”ҹеҰӮдёӢдёҖдәӣеҸҚеә” В в‘ IO3- +3HSO3- = 3SO42- + 3H+ + I- пјҲж…ўпјүв‘ЎIO3- +5I- +6H+ = 3I2 + 3H2OпјҲж…ўпјү В в‘ўI2 +HSO3- + H2O = 2I- +SO42вҖ” +3H+пјҲеҝ«пјү еҲҶеҲ«й…ҚеҲ¶дёӢйқўдёүз§Қжә¶ж¶І. В жә¶ж¶ІAпјҡ0.9gзўҳй…ёй’ҫжә¶дәҺе°‘йҮҸжё©ж°ҙдёӯпјҢеҶҚзЁҖйҮҠеҲ°500mL. В В жә¶ж¶ІBпјҡ0.45gдәҡзЎ«й…ёй’ й…ҚжҲҗжә¶ж¶ІпјҢзЁҖйҮҠеҲ°500mL. жә¶ж¶ІCпјҡеҸ–5gеҸҜжә¶жҖ§ж·ҖзІүпјҢж”ҫеңЁе°Ҹзғ§жқҜдёӯпјҢеҠ е…Ҙ25mLеҶ·ж°ҙпјҢжҗ…жӢҢжҲҗжӮ¬жөҠж¶І.еҸҰеҸ–200mLж°ҙеҠ зғӯиҮіжІёпјҢи¶ҒжІёи…ҫж—¶еҖ’е…Ҙж·ҖзІүжӮ¬жөҠ液并иҝ…йҖҹжҗ…жӢҢпјҢдҪҝж·ҖзІүзіҠеҢ–гҖҒжә¶и§Ј.еҲ°жә¶ж¶ІеҶ·еҚҙеҗҺиҫ№жҗ…жӢҢиҫ№ж…ўж…ўеҠ е…Ҙ12.5mLжө“зЎ«й…ёпјҢжңҖеҗҺд№ҹзЁҖйҮҠеҲ°500mL. В жә¶ж¶І Dпјҡ200mLж°ҙ+50mLAж¶І+50mLCж¶І В жә¶ж¶І Eпјҡ225mLж°ҙ+25mLAж¶І+50mLCж¶І иҜ•еӣһзӯ”дёӢеҲ—й—®йўҳгҖҒ (1).ж №жҚ®е®һйӘҢеҺҹзҗҶпјҢеҢ–еӯҰеҸҚеә”йҖҹзҺҮз”ұйӮЈжӯҘеҸҚеә”еҶіе®ҡВ В В В В В В В В В В В В .[еЎ«в‘ гҖҒв‘ЎгҖҒв‘ў ] (2).еҪ“е“Әз§ҚзҰ»еӯҗиҖ—е°Ҫж—¶жүҚиғҪи§ҒеҲ°жә¶ж¶ІеҸҳи“қиүІ______.(йҖүеЎ«пјҡIвҖ”гҖҒHSO3вҖ”гҖҒH+гҖҒIO3вҖ”) (3).еңЁзӣӣж”ҫDж¶Іе’ҢEж¶Ізҡ„дёӨеҸӘзғ§жқҜйҮҢеҗҢж—¶еҠ е…Ҙ50mLBж¶І.DгҖҒEдёӨзғ§жқҜе“ӘдёӘжә¶ж¶Іе…ҲеҸҳи“қиүІ__________(еЎ«пјҡDгҖҒE) (4).дёәз ”з©¶жё©еәҰеҜ№еҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ еҮҶеӨҮдёүд»ҪEж¶ІпјҲеҗ„30OmLпјҢй…Қжі•еҗҢдёҠпјүгҖҒз”Ёдёүж”ҜйҮҸзӯ’еҲҶеҲ«йҮҸеҸ–50mL Bж¶ІпјҢеҗҢж—¶жҠҠдёүд»ҪBж¶ІеҲҶеҲ«еҠ е…ҘдёӢиҝ°дёҚеҗҢжё©еәҰзҡ„дёүд»ҪEж¶ІдёӯгҖӮ В a第дёҖд»Ҫж”ҫеңЁзҹіжЈүзҪ‘дёҠеҠ зғӯеҲ°50в„ғе·ҰеҸіпјҢb第дәҢд»Ҫз»ҙжҢҒеңЁе®Өжё©пјҢc第дёүд»ҪжөёеңЁеҶ°ж°ҙйҮҢеҶ·еҚҙеҲ°иҝ‘еҶ°зӮ№.е…ҲеҸҳи“қиүІзҡ„жҳҜ___________гҖӮпјҲеЎ«пјҡaгҖҒbгҖҒcпјү
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||
|
зўіеҸҠе…¶еҢ–еҗҲзү©жңүе№ҝжіӣеә”з”ЁгҖӮ пјҲ1пјүе·ҘдёҡеҶ¶зӮјй“қпјҢд»ҘзҹіеўЁдёәйҳіжһҒгҖӮйҳіжһҒеҸҚеә”ејҸдёәВ В В В В В В пјҢеҸҜиғҪеҸ‘з”ҹеүҜеҸҚеә”жңүВ В В В В В гҖӮ пјҲ2пјүдёҖж°§еҢ–зўіе’Ңз©әж°”еңЁй…ёжҖ§д»ӢиҙЁдёӯжһ„жҲҗзҮғж–ҷз”өжұ пјҢиҙҹжһҒеҸҚеә”ејҸдёәВ В В В В В В В В В гҖӮеҰӮжһңзҗҶи®әиҫ“еҮәз”өеҺӢдёә1.50VпјҢиғҪйҮҸеҜҶеәҰE=В В В В В В В В В В В В В гҖӮ пјҲ3пјүеҗ‘75 mL 4 molвҖўL-1KOHжә¶ж¶Ідёӯзј“ж…ўйҖҡе…Ҙ4480 mL CO2ж°”дҪ“пјҲж ҮеҮҶзҠ¶еҶөпјүжҒ°еҘҪе®Ңе…Ёиў«еҗёж”¶гҖӮв‘ еҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎиҜҘеҗёж”¶жә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰеӨ§е°ҸжҺ’еәҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ўеёёжё©дёӢпјҢa molвҖўL-1KHCO3жә¶ж¶Ізҡ„pH=8пјҢHCO3-зҡ„ж°ҙи§Јеёёж•°зәҰзӯүдәҺВ В В В В В В В В гҖӮпјҲз”Ёеҗ«aејҸиЎЁзӨәпјүгҖӮ пјҲ4пјүе·ІзҹҘпјҡв‘ 2H2(g)+O2(g)=2H2O(l)В В В В В В В В в–іH1= в‘Ў 2CO(g)+O2(g)=2CO2(g)В В В В В В В в–іH2 = вҖ”566.0kJвҖўmol-1 В В В В В В В В В В в‘ў CO(g)+2H2(g) и®Ўз®—з”ІйҶҮи’ёж°”зҡ„зҮғзғ§зғӯ пјҲ5пјүжҹҗжё©еәҰдёӢпјҢеҸ‘з”ҹеҸҜйҖҶеҸҚеә”пјҡCO(g)пјӢH2O(g) в‘ еҗ‘жҹҗе®№еҷЁдёӯе……е…Ҙ1.0 molH2е’Ң1.0 molCO2(g)пјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹдёҠиҝ°еҸҚеә”гҖӮж··еҗҲж°”дҪ“дёӯCO2зҡ„зү©иҙЁзҡ„йҮҸдёҺж—¶й—ҙе…ізі»еҰӮдёӢеҲ—жүҖзӨәпјҡ
зӣёеҜ№е®һйӘҢIпјҢе®һйӘҢIIеҸҜиғҪж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜВ В В В В В В пјҢиҜҘжё©еәҰдёӢпјҢе№іиЎЎеёёж•°=В В В В В В гҖӮ в‘ЎиӢҘејҖе§Ӣеҗ‘з»қзғӯе®№еҷЁдёӯжҠ•е…ҘдёҖе®ҡйҮҸдәҢж°§еҢ–зўігҖҒж°ўж°”еңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹдёҠиҝ°еҸҜйҖҶеҸҚеә”гҖӮ дёӢеҲ—еӣҫеғҸжӯЈзЎ®дё”иҜҙжҳҺеҸҜйҖҶеҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜВ В В В В В В В В В В В гҖӮпјҲеЎ«еәҸеҸ·пјү
|
||||||||||||||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
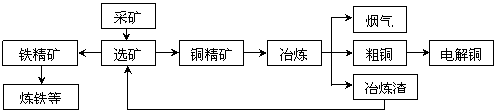
жҹҗеҢ–е·ҘеҺӮеҶ¶зӮјйҮ‘еұһгҖҒеӣһ收硫зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
IпјҺеӣһ收硫 пјҲ1пјүе·ҘдёҡдёҠпјҢйҮҮз”ЁйҘұе’ҢдәҡзЎ«й…ёй’ жә¶ж¶Іеҗёж”¶зғҹж°”дёӯдәҢж°§еҢ–зЎ«пјҢеҶҷеҮәзҰ»еӯҗж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ 然еҗҺпјҢеҠ зғӯеҗёж”¶ж¶Іж”¶йӣҶSO2гҖӮе°ҶдәҢж°§еҢ–зЎ«гҖҒз©әж°”еңЁзЁҖзЎ«й…ёдёӯжһ„жҲҗеҺҹз”өжұ пјҢиҙҹжһҒеҸҚеә”ејҸдёәВ В В В В В В В В В В В В В В В В В В В В гҖӮ IIпјҺеҶ¶зӮјй“ң
пјҲ3пјүз”Ёз”өи§Јжі•зІҫзӮјзІ—й“ңпјҲеҗ«й“¶гҖҒйҮ‘гҖҒй“ҒгҖҒй”ҢжқӮиҙЁпјүпјҢиЈ…зҪ®еҰӮеӣҫжүҖзӨәгҖӮ дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В гҖӮ AпјҺYжһҒдёәзІ—й“ңгҖҒXжһҒдёәзәҜй“ңВ В BпјҺXжһҒеҮҖеўһиҙЁйҮҸзӯүдәҺYжһҒеҮҖеҮҸиҙЁйҮҸ CпјҺй“ңзӣҗжә¶ж¶ІйғҪеҸҜд»ҘдҪңзІҫзӮјй“ңзҡ„з”өи§ЈиҙЁжә¶ж¶І DпјҺиӢҘз”өи·Ҝжңү1 molз”өеӯҗиҪ¬з§»пјҢеҲҷXжһҒеҮҖеўһ32 g пјҲ4пјүеҮ з§ҚйҮ‘еұһзҰ»еӯҗзҡ„жІүж·ҖpHпјҡ
й“ңзӣҗжә¶ж¶ІдёӯFe2+пјҢZn2+еҜ№зІҫзӮјй“ңеҸҜиғҪдјҡдә§з”ҹеҪұе“ҚгҖӮе·ҘдёҡдёҠпјҢйҷӨеҺ»Fe2+ж–№жі•жҳҜпјҢеңЁй…ёжҖ§ж··еҗҲжә¶ж¶ІдёӯеҠ е…ҘВ В В В В В В В В В В В В (йҖүеЎ«пјҡеҸҢж°§ж°ҙ IIIпјҺеҶ¶зӮјй“Ғ пјҲ5пјүеҢ–е·ҘеҺӮеҲ©з”ЁиҸұй“ҒзҹҝпјҲдё»иҰҒжҲҗеҲҶжҳҜзўій…ёдәҡй“ҒпјүеҶ¶зӮјй“Ғзҡ„еҺҹзҗҶжҳҜпјҲз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәпјүпјҡВ В В В В В В В В В гҖӮз”ҹй“ҒзӮјй’ўзҡ„дё»иҰҒеҺҹзҗҶжҳҜВ В В В В В В В В В В В В В В гҖӮ пјҲ6пјүз”ҹй“ҒеңЁж№ҝж¶Ұз©әж°”дёӯеҸ‘з”ҹз”өеҢ–еӯҰи…җиҡҖжңҖз»Ҳз”ҹжҲҗзәўиүІй“Ғй”ҲпјҢйҮ‘еұһз”өеҢ–и…җиҡҖзұ»еһӢдёәВ В В В В В В В гҖӮ
|
||||||||||||||||
| 25. | иҜҰз»ҶдҝЎжҒҜ | |||
|
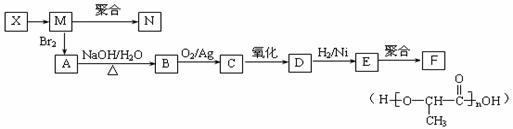
ж №жҚ®дёӢеҲ—жңүжңәеҢ–еҗҲзү©пјҢеӣһзӯ”й—®йўҳгҖӮ
В В пјҲ1пјүдёҠиҝ°дә’дёәеҗҢеҲҶејӮжһ„дҪ“зҡ„еҢ–еҗҲзү©дёәВ В В В В В В пјҲ2пјүеҶҷеҮәдёҷдёӯе®ҳиғҪеӣўзҡ„еҗҚз§°В В В В В В В В В В В В В пјӣ В В пјҲ3пјүдёҒеңЁдёҖе®ҡжқЎд»¶дёӢпјҢеҸҜд»ҘеҸ‘з”ҹж°ҙи§ЈеҸҚеә”пјҢз”ҹжҲҗXгҖҒYдёӨз§Қзү©иҙЁпјҲзӣёеҜ№еҲҶеӯҗиҙЁйҮҸпјҡXпјңYпјүгҖӮз”ұXз»ҸдёӢеҲ—еҸҚеә”еҸҜеҲ¶еҫ—NгҖҒFдёӨз§Қй«ҳеҲҶеӯҗеҢ–еҗҲзү©пјҢе®ғ们йғҪжҳҜеёёз”Ёзҡ„еЎ‘ж–ҷгҖӮ
в‘ XиҪ¬еҢ–дёәMзҡ„еҸҚеә”зұ»еһӢжҳҜВ В В В В В В В В В В В В гҖӮ в‘ЎеҶҷеҮәBиҪ¬еҢ–дёәCзҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ўCдёҺж–°еҲ¶ж°ўж°§еҢ–й“ңеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЈеңЁдёҖе®ҡжқЎд»¶дёӢпјҢдёӨеҲҶеӯҗEиғҪи„ұеҺ»дёӨеҲҶеӯҗж°ҙеҪўжҲҗдёҖз§Қе…ӯе…ғзҺҜзҠ¶еҢ–еҗҲзү©пјҢиҜҘеҢ–еҗҲзү©зҡ„з»“жһ„з®ҖејҸдёәВ В В В В В В В В В В В В В В гҖӮ в‘ӨеҶҷеҮә3з§Қеҗ«жңүдёҖдёӘзҫҹеҹәгҖҒдёҖдёӘй…Ҝеҹәзҡ„Eзҡ„еҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸпјҡ В В В В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В В В гҖӮ В |
||||
- жө·еҚ—дёӯеӯҰй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- жҷ®жҙұеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- 2019-2020е№ҙй«ҳдёүдёҠеӯҰжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеұұдёңзңҒж·„еҚҡеёӮ第дёғдёӯеӯҰпјү
- еӨҜеҹәжҸҗиғҪй«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ йўҳе…Қиҙ№иҜ•еҚ·
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲжұҹиӢҸзңҒеҚ—йҖҡеёӮеҗҜдёңеёӮпјү
- еҗүжһ—2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- йҷ•иҘҝзңҒе’ёйҳіеёӮ2020-2021е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«ж•ҷеӯҰиҙЁйҮҸжЈҖжөӢеҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ