2019四川高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列过程中,不需要外加电源就能进行的是 ①电解②电镀③电离④电化学腐蚀 A. ①② B. ①③ C. ②③ D. ③④
|
|
| 2. | 详细信息 |
|
实验室利用石灰石与稀盐酸反应制取二氧化碳,为了降低其反应速率,下列措施可行的是 A. 使用浓盐酸 B. 向反应体系中加入氯化钙晶体 C. 提高反应温度 D. 向反应体系中加入蒸馏水
|
|
| 3. | 详细信息 |
|
已知反应2A(g) A. 减小容器容积 B. 增大容器容积 C. 减小B的浓度 D. 降温
|
|
| 4. | 详细信息 |
|
下列化学用语正确的是 A. 硝基苯的结构简式: C. 过氧化氢的电子式:
|
|
| 5. | 详细信息 |
|
NA为阿伏加德罗常数的值,下列叙述正确的是 A.1.0 L 1.0 mol•L﹣1 的NaAlO2水溶液中含有的氧原子数为2 NA B.常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1 C.标准状况下,11.2L 18O2中所含中子数为8NA D.25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2
|
|
| 6. | 详细信息 |
|
锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是
A. 该电池中的有机溶剂不能含活性较大的氢 B. 充电时,Y为阳极,Li+向X电极移动 C. 放电时,负极反应为2Li+CO32-—2e-=Li2CO3 D. 放电时,电池总反应为3CO2+4Li=2Li2CO3+C
|
|
| 7. | 详细信息 | |||
|
室温下,用0.100mol•L﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100mol•L﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是 A. a表示的是醋酸的滴定曲线 B. 滴定b过程中,指示剂可以是酚酞 C. pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
|
||||
| 8. | 详细信息 | ||||||
|
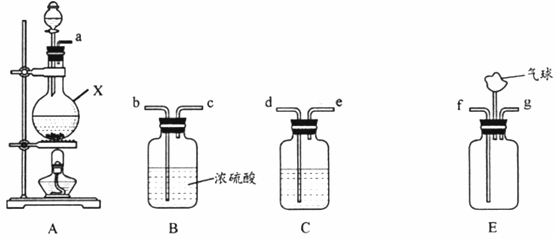
氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
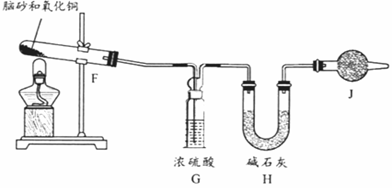
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。 (2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。 (3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。 (4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
①为顺利完成有关物理量的测定,请完善下列表格:
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
|
|||||||
| 9. | 详细信息 |
|
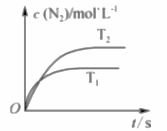
低碳环保,减轻大气污染,必须从源头上对尾气进行净化处理。回答下列问题 (1)汽车尾气催化转换器中的反应为2NO(g)+2CO(g)
①由图甲可知,温度T1_____T2(填“>”或“<”,下同);该反应的△H_____0。 ②能提高尾气转化率的措施有_____(填字母)。 a.升高温度 b.降低温度 c.增大压强 d.增大催化剂的比表面积 (2)煤燃烧产生的烟气中含有氮氧化物,可用CH4催化还原NOx,消除氮氧化物的污染。已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,②N2O4(g)⇌2NO2(g)△H=+56.9k•mol﹣1,③CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣810.1kJ•mol﹣1,从原电池的工作原理分析,可设计为原电池的反应为_____(填序号)。 (3)下图是通过光电转化原理,以燃煤产生的二氧化碳为原料,制备新产品的示意图。试写出光电转化过程中总反应的化学方程式:_____;催化剂a、b之间连接导线上的电流方向是_____。
|
|
| 10. | 详细信息 |
|
从海水中提取一些重要的化工产品的工艺流程如图所示。
根据上述流程图回答下列问题: (1)图中A的化学式为 ___________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为________________。 (2)海水淡化处理的方法有_____________________。(写出2种即可) (3)过程⑤的化学方程式为 _________________________________。 (4)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式___________。 (5)过程②到过程④的变化为“Br→Br2→Br→Br2”,其目的是__________。
|
|
| 11. | 详细信息 | ||||||||||||
|
某原料经测定主要含有A、B、C、D、E五种原子序数依次增大的前四周期元素,其相关信息如下:
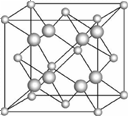
请回答下列问题(用A、B、C、D、E所对应的元素符号作答): (1) B、C、D第一电离能由大到小的顺序为_____。(2) E的二价离子的电子排布式为_____。 (3) A2B2D4常用作除锈剂,该分子中B的杂化方式为_____;1 mol A2B2D4分子中含有σ键与π键的数目之比为_____。 (4) 与化合物BD互为等电子体的阴离子的化学式为_____(任写一种)。 (5) B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是___。 (6) 一种E和金(Au)形成的合金晶体具有面心立方最密堆积结构,其晶胞中E原子处于面心,Au原子处于顶点,则该合金中E原子与Au原子的个数之比为___;若相临两个Au原子的最短距离为a厘米,则该合金的密度为_____g/cm3。又知上述晶体具有储氢功能,氢原子可进入到由E原子与Au原子构成的四面体空隙中。若将E原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见图)的结构相似,该晶体储氢后的化学式应为_____。
|
|||||||||||||
| 12. | 详细信息 |
|
肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(
请回答下列问题: (1)化合物A的结构简式为_____________,D中含有官能团的名称为_________________。 (2)B→C所加试剂的名称是______________,F→G的反应类型为__________。 (3)G→H的化学方程式为______________________________。 (4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_______________________________。
|
|