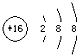2017辽宁高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列有关说法正确的是( ) A. 活化分子之间发生的碰撞一定为有效碰撞 B. 升高温度,降低反应的活化能,可使活化分子的百分数增大,因而反应速率增大 C. 金属腐蚀就是金属失去电子被氧化的过程 D. 电解法精炼铜时,以粗铜作阳极,粗铜中的所有金属都以离子的形式进入电解质溶液
|
|
| 2. | 详细信息 |
|
下列化学用语正确的是( ) A. H2S的电子式: C. Na2O2的电子式:
|
|
| 3. | 详细信息 |
|
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
A. 工业上电解YW饱和溶液冶炼金属Y B. 气态氢化物的稳定性:W>X C. 简单离子半径的大小顺序:r(Y+)>r(X-) D. Y、W的最高价氧化物的水化物均能溶解金属Z
|
|
| 4. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是( ) A. Fe(SCN)3溶液中存在Fe3++3SCN﹣ B. 用通过盛饱和食盐水的洗气瓶来除去氯气中的少量HCl气体杂质 C. 反应CO(g)+NO2(g) D. 合成氨:N2(g)+3H2(g)
|
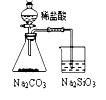
|
| 5. | 详细信息 |
|
已知H—H键的键能为436 kJ/mol,O=O键的键能为498 kJ/mol,热化学方程式H2(g)+ A. 485.5 kJ/mol B. 610 kJ/mol C. 917 kJ/mol D. 1220 kJ/mol
|
|
| 6. | 详细信息 |
|
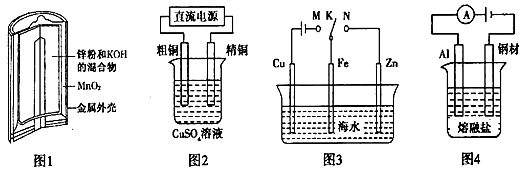
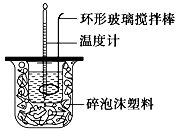
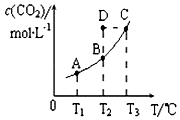
下列有关电化学装置的叙述正确的是( )
A. 图1中,Zn—MnO2干电池放电时,MnO2被氧化 B. 图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 C. 图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-= 4Al2Cl7- D. 图3中,K分别与M、N连接,均可保护Fe电极,连接M时为“牺牲阳极的阴极保护法”
|
|
| 7. | 详细信息 |
|
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
某兴趣小组的实验数值结果大于57.3 kJ·mol-1(中和热),原因可能是( ) A. 实验装置中小烧杯杯中低于大烧杯杯口 B. 用浓硫酸代替了稀硫酸 C. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 D. 用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
|
|
| 8. | 详细信息 |
|
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ( ) ①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) A. ①⑥⑦ B. ③⑤ C. ③⑦ D. ⑤⑦
|
|
| 9. | 详细信息 |
|
在一定条件下,将3 mol A和1 mol B两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g) A. A的转化率为40% B. 2 min内B的反应速率为0.2 mol·L-l.min-1 C. x=2 D. 若混合气体的密度不变,则表明该反应已达到平衡状态
|
|
| 10. | 详细信息 |
|
将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 B. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 C. 4.0 mol SO2+1.0 mol O2 D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
|
|
| 11. | 详细信息 |
|
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
下列说法错误的是( ) A. 在T2时,若反应进行到状态D,则一定有v正<v逆 B. 平衡状态A与C相比,平衡状态A的c(CO)小 C. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 D. 反应CO(g)+H2O(g)
|
|
| 12. | 详细信息 |
|
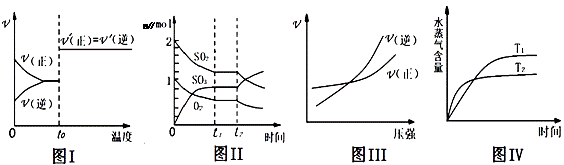
下列图示与对应叙述相符合的是 ( )
A. 图I:反应H2+I2 B. 图Ⅱ:反应2SO2+O2 C. 图III:反应N2+3H 2 D. 图IV:反应CO2(g)+H2(g)
|
|
| 13. | 详细信息 |
|
下列叙述错误的是( ) (1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q (2)阴、阳离子通过静电吸引形成的化学键叫离子键 (3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高 (4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 (5)都是由非金属元素形成的化合物可能是共价化合物 A. 全部 B. (1)(2)(3)(4) C. (1)(2)(3) D. (2)(3)(4)
|
|
| 14. | 详细信息 | ||||||||||||
|
已知某化学反应的平衡常数表达式为K=
下列有关叙述正确的是( ) A. 该反应的化学方程式是: H2(g)+CO2(g) B. 上述反应的正反应是吸热反应 C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态 D. 某温度下,如果平衡常数符合下列关系式:
|
|||||||||||||
| 15. | 详细信息 |
|
. 全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为: VO2+(蓝色)+H2O+V3+(紫色) 下列说法错误的( ) A. 充电时,反应每生成1mol H+时电子转移的物质的量为1mol B. 放电过程中,正极附近溶液的酸性减弱 C. 放电时,正极反应为VO2+ + 2H+ + e— = VO2+ +H2O D. 充电时,阴极附近溶液由紫色逐渐变为绿色
|
|
| 16. | 详细信息 | |||||||||||||||
|
用下列实验装置进行相应的实验,不能达到实验目的是( )
A. A B. B C. C D. D
|
||||||||||||||||
| 17. | 详细信息 |
|
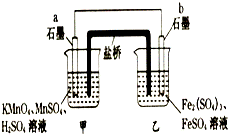
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 设计如下原电池,盐桥中装有饱和K2SO4琼脂溶液.
下列说法正确的是( ) A. a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O B. 外电路电子的流向是从a到b C. 电池工作时,盐桥中的SO42﹣移向甲烧杯 D. b电极上发生还原反应
|
|
| 18. | 详细信息 |
|
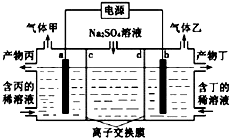
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法不正确的是( )
A. a极与电源的正极相连 B. 产物丙为硫酸溶液 C. 离子交换膜d为阳离子交换膜(允许阳离子通过) D. a电极反应式为2H++2e﹣═H2↑
|
|
| 19. | 详细信息 |
|
碳酸钙受热分解的方程式为CaCO3(S) A. 增大 B. 减小 C. 不变 D. 无法判断
|
|
| 20. | 详细信息 |
|
下列说法正确的是( ) A. 工业上常通过电解熔融的MgO冶炼金属镁 B. 应用盖斯定律,可计算某些难以直接测量的反应焓变 C. 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 D. 在铁上镀铜,应选用铜作阴极
|
|
| 21. | 详细信息 |
|
已知:短周期元素A、B、C、D、E的原子序数依次增大。 ①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色; ②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,A、E同主族,C与B、D相邻; ③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3。 请回答下列问题: (1)C原子在周期表的位置为___________;写出化合物EDA的电子式________。 (2)C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,写出其化学式________; (3)F溶液与足量EDA的稀溶液混合加热,其离子方程式为_____________________。 (4)氯气与C的简单气态氢化物相遇有白烟及C2生成,写出反应方程式_____________。 (5)用CH4可以消除汽车尾气中氮氧化物的污染。 已知:CH4(g)+2NO2(g) 2NO2(g) 写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:___________________。
|
|
| 22. | 详细信息 |
|
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题: (1)高炉炼铁是CO气体的重要用途之一,其基本反应为: FeO(s)+CO(g) 已知在1100°C时,该反应的化学平衡常数K=0.263. ①温度升高,平衡移动后达到新平衡,此时平衡常数值________(填“增大”“减小”“不变”); ②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________进行(填“左”或“右”). (2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)
①反应开始至平衡,氢气的平均反应速率v(H2)=__________,CO2的转化率为_______. 该温度下上述反应的平衡常数K=____________(分数表示). ②反应达到平衡后,下列能使 a.升高温度 b.再充入H2 c.再充入CO2 d.将H2O(g)从体系中分离 e.充入He(g) ③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________。 ④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________。
|
|
| 23. | 详细信息 |
|
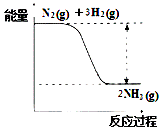
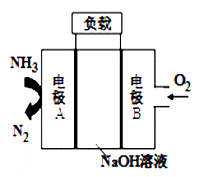
氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 合成氨的反应中的能量变化如图所示。
①该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。 ②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。 A.容器中混合气体的密度不随时间变化 B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键 C.N2 、H2 、NH3的物质的量之比为1:3:2 D.容器中混合气体的平均相对分子质量不随时间变化 ③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:
电极A上发生的电极反应为:_____________________。 若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______mol.
|
|
| 24. | 详细信息 |
|
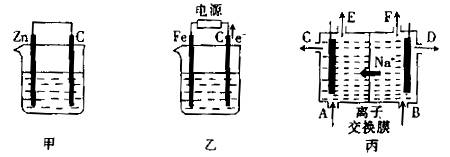
下图中甲、乙是电化学实验装置图,丙是氯碱工业生产示意图。
(1)若甲、乙两装置的烧杯中均盛有 ①表面有红色物质析出的电极是:甲装置中的_______棒,乙装置中的________棒。 ②乙装置中碳棒表面发生的电极反应式是______________________。 ③若起始时乙中盛放100 mL (2)若甲、乙两装置的烧杯中均盛有饱和NaCl溶液; ①写出甲装置中碳棒表面发生的电极反应式:______________________________。 ②已知: ③工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,
|
|