2018高三上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( ) A.二氧化硫可用于杀菌、消毒 B.煤经过气化和液化等物理变化可转化为淸洁能源 C.氯气和明矾均可做自来水的消毒剂 D.食品保鲜剂中所含铁粉和生石灰均作还原剂
|
|
| 2. | 详细信息 |
|
简单原子的原子结构可用如下图的表示方法形象地表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( ) A. ①②③三种原子形成的单质互称为同素异形体 B. ①②③三种原子形成的单质混合在一起是纯净物 C. ①②③是三种化学性质相同的粒子 D. ①②③互为同位素
|
|
| 3. | 详细信息 |
|
类比推理的方法在化学学习与研究中有广泛的应用;但有时会得出错误的结论。以下几种类比推理结论中正确的是( ) A. CO2通入Ba(NO3)2溶液中无沉淀生成;推出SO2通入Ba(NO3)2溶液中无沉淀生成 B. Fe3Cl8可以改写为FeCl2·2FeCl3;推出Fe3I8可以改写为FeI2·2FeI3 C. CO2的沸点较低;推出 SiO2沸点也较低 D. H2SO4为强酸;推出HClO4为强酸
|
|
| 4. | 详细信息 |
|
下列现象或事实可用同一原理解释的是( ) A.浓硫酸和浓盐酸长期暴露在空气中浓度均降低 B.乙烯能使酸性高锰酸钾溶液和溴水均褪色 C.氯水和浓硝酸均要盛装在棕色试剂瓶中 D.NaCl固体中混有NH4Cl或I2,均可用加热法除去
|
|
| 5. | 详细信息 |
|
下列离子方程式书写正确的是( ) A. Fe2O3溶于足量氢碘酸:Fe2O3 + 6H+ = 2Fe3+ + 3H2O B. 用铁作电极电解饱和NaC1溶液:2Cl–+2H2O C. 澄清的石灰水中加入过量的 NaHCO3溶液:Ca2++2OH-+2HCO3--═CaCO3↓+CO32--+H2O D. 向含1mol FeBr2的溶液中通入1.5mol Cl2:10Fe2+ + 4Br‾+ 8Cl2 = 10Fe3+ + 2Br2 + 16Cl‾
|
|
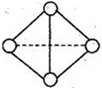
| 6. | 详细信息 | |||||||||||||||||||||||||
|
下表各组物质中,物质之间不可能实现如下图所示转化的是( )
|
||||||||||||||||||||||||||
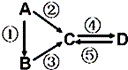
| 7. | 详细信息 |
|
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是( ) A. 离子半径: D离子>C离子 > B离子 B. 等质量的D和足量的X、Y溶液反应产生 的气体的质量相同 C. 电解C、E形成的化合物的水溶液可生成 C、E对应的单质 D. 由A、B、E三种元素形成的化合物一定是强电解质
|
|
| 8. | 详细信息 |
|
下列物质中不能用化合反应的方法制得的是( ) ①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥CaSiO3 A. ①③ B. ②④ C. ②③④⑤ D. ②④⑥
|
|
| 9. | 详细信息 |
|
设NA为阿伏加德罗常数值,下列有关叙述正确的是( ) A..1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA B.1 mol冰醋酸中含有NA个CH3COO- C.18g重水(D2O)中含有的电子数为10NA D..22.4氯气与足量的铁反应转移电子数为2NA
|
|
| 10. | 详细信息 | ||||||||||||||||||||
|
物质中杂质(括号内为杂质)的检验方法、除杂的试剂都正确的是( )
|
|||||||||||||||||||||
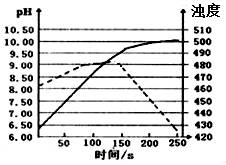
| 11. | 详细信息 |
|
A. 实线表示溶液浊度随时间的变化 B. 50s时向溶液中滴入酚酞试液,溶液变红 C. 该实验是在常温下进行的 D. 150s后溶液浊度下降是因为生成的Mg(OH)2沉降
|
|
| 12. | 详细信息 |
|
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子 NF3 和一种铵盐 M,下列有关说法错误的是( ) A. 该反应的化学方程式为 4NH3 3F2 =NF3 3NH4F B. 生成0.1mol NF3时被氧化的氨气是0.4mol C. NF3 既是氧化产物,又是还原产物 D. 铵盐M中既含有离子键,又含有共价键
|
|
| 13. | 详细信息 |
|
如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈血红色。判断下列说法中错误的是( ) A. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 B. 该条件下H2燃烧的产物中可能含有一定量的H2O2 C. 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 D. 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
|
|
| 14. | 详细信息 |
|
下列药品和装置合理且能完成相应实验的是( )
A. 制备氢氧化亚铁 B. 验证非金属性Cl>C>Si C. 检验二氧化硫中是否混有二氧化碳 D. 实验室制取并收集氨
|
|
| 15. | 详细信息 |
|
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是( ) A. NO B. NO2 C. N2O D. NH4NO3
|
|
| 16. | 详细信息 |
|
实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 B.溶液中n(NH C.b点与a点的差值为0.06 mol D.样品中铝粉和铁粉的物质的量之比为1:4
|
|
| 17. | 详细信息 |
|
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大, W与R同主族,且W的氢化物常温时为液态。X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子。 请用化学用语回答下列问题: (1)Y、Z、W元素的氢化物稳定性由高到低的顺序为 (用化学式表示)。 (2)T离子的结构示意图为 Y的最高价氧化物的结构式为 。 (3)请用一个化学方程式证明W元素的非金属性强于R元素 。
|
|
| 18. | 详细信息 |
|
(1)若A是太阳能电池用的光伏材料,B为A单质的氧化物,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。 写出B→C的离子方程式: (2)若B为淡黄色固体,②③反应均用到同一种液态氢化物,D物质常用于食品工业。 B所含化学键的类型是 。写出B→C的化学方程式: . (3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入一种过量的能引起温室效应的主要气体.写出C→D的离子方程式: . (4)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种非金属单质。写出C→D的离子方程式: .
|
|
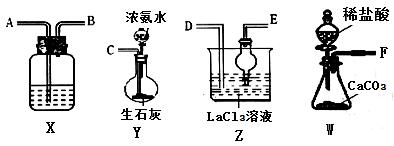
| 19. | 详细信息 |
|
碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaC13 + 6NH4 HCO3 = La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
(l)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →D →E→ 。 (2)X中盛放的试剂是______________,其作用为_______________________________。 (3)Z中为得到浓度较大的NH4HCO3溶液,应先通入 ,后通入过量的_______。(填化学式) (4)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mL NH3—NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-=LaY-+2H+),消耗EDTA 溶液44.0 mL。则产品中La2(CO3)3的质量分数ω[ La2(CO3)3 ]=_________。[ 已知La2(CO3)3 的摩尔质量是458g/mol ] (5)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______(填化学式);实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为______________。
|
|
| 20. | 详细信息 |
|
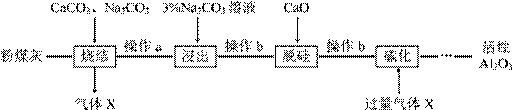
粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
已知:①烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。②浸出过程中,NaFeO2可完全水解。 (1)写出烧结过程中铝元素转化的化学方程式 。 (2)操作a为冷却、研磨,其中研磨的目的是 。 (3)操作b的名称是_________,所用的玻璃仪器有__________、_______和烧杯。 (4)“碳化”时生成沉淀,此反应的化学方程式为 。
|
|
| 21. | 详细信息 |
|
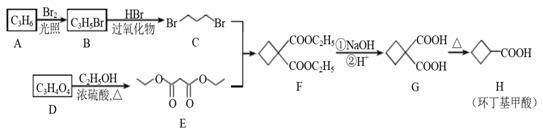
环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:
回答以下问题: (1)A属于烯烃,B的结构简式为______________________。 (2)B→C的反应类型是____________________________。 (3)E的化学名称是____________________________。 (4)写出同时满足下列条件的G的所有同分异构体 ___________________________________________________(写结构简式,不考虑立体异构)。 ① 核磁共振氢谱为3组峰; ② 能使溴的四氯化碳溶液褪色; ③ 1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。 (5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式__________________________________________________。
|
|