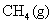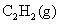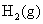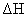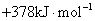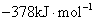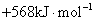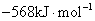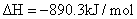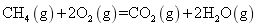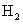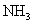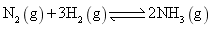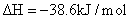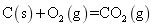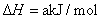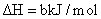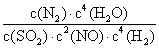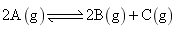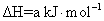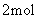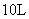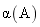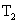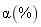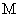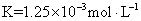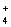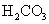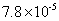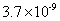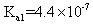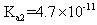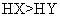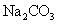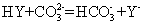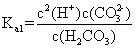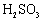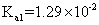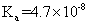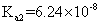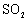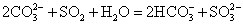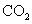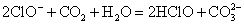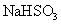安徽省2021-2022学年高二上学期期中考试化学试题含解析
| 1. | 详细信息 |
|
2020 年 11 月 24 日,我国长征五号运载火箭成功发射升空, 12 月 17 日 “ 嫦娥五号 ” 探测器完成探月任务后顺利返回。下列有关说法错误的是 A . 运载火箭通常采用联氨 (N 2 H 4 ) 、煤油、液氢等新能源作为燃料 B . 探测器采用的太阳能电池帆板主要成分为晶体硅 C . 探测器表面的耐高温隔热陶瓷瓦为新型无机非金属材料 D . 运载火箭采用铝合金材料作框架结构,主要利用其质量轻、强度高等优点 |
|
| 2. | 详细信息 |
|
S( 单斜 ) 和 S( 正交 ) 是硫的两种同素异形体。 已知: ①S( 单斜, s)+O 2 (g)=SO 2 (g) △ H 1 = — 297.16 kJ/mol ②S( 正交, s) +O 2 (g)=SO 2 (g) △ H 2 = — 296.83 kJ/mol ③S( 单斜, s)= S( 正交, s) △ H 3 下列说法正确的是 A . 单斜硫的能量比正交硫的能量低 B . △ H 3 = — 0.33 kJ/mol C . S( 单斜, s)= S( 正交, s) △ H 3 > 0 ,正交硫比单斜硫稳定 D . S( 单斜, s)= S( 正交, s) △ H 3 < 0 ,单斜硫比正交硫稳定 |
|
| 3. | 详细信息 | ||||||||
|
已知几种可燃物的燃烧热如下表所示:
则 A . C . |
|||||||||
| 4. | 详细信息 |
|
下列热化学方程式正确的是 A . 甲烷的燃烧热 B . 500℃ 、 30MPa 下,将 0.5mol C . 增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多 D . 已知 |
|
| 5. | 详细信息 |
|
将等物质的量的 A 、 B 混合于 2L 的密闭容器中,发生下列反应: 3A(g)+B(g) A . 反应速率 v(B)=0.25mol • L -1 • min -1 B . 该反应方程式中, x=1 C . 2min 时, A 的物质的量为 2.0mol D . 2min 时, A 的转化率为 50% |
|
| 6. | 详细信息 |
|
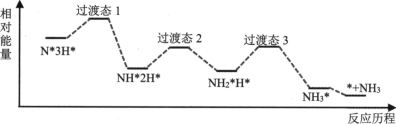
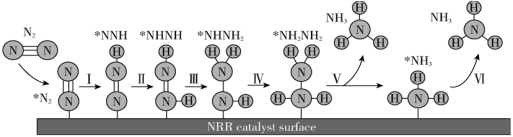
文献报道:在 45 ℃、 0.1 MPa 时,科学家以铁粉为催化剂,通过球磨法合成氨。部分反应历程如图所示 ( 吸附在催化剂表面的物种用 * 标注 ) ,下列说法正确的是 A . 由此历程可知: N* + 3H* = NH* + 2H* ΔH>0 B . 铁粉改变了合成氨的反应历程和反应热 C . 图示过程中有极性共价键的生成 D . 用不同催化剂合成氨,反应历程均与上图相同 |
|
| 7. | 详细信息 |
|
对于 A 2 + 3B 2 ⇌ 2C+D 的反应来说,以下化学反应速率的表示中,反应速率最快的是 A . v (A 2 ) = 0.4 mol·L - 1 ·s - 1 B . v (B 2 ) = 0.6mol·L - 1 ·s - 1 C . v (C) = 1.2 mol·L - 1 ·min - 1 D . v (D) = 0.1mol·L - 1 ·s - 1 |
|
| 8. | 详细信息 |
|
氢气用于烟气的脱氮、脱硫的反应: 4H 2 (g)+2NO(g)+SO 2 (g) A . 当 v(H 2 )=v(H 2 O) 时,达到平衡 B . 升高温度,化学平衡正向移动 C . 使用高效催化剂可提高 NO 的平衡转化率 D . 化衡常数学平表达式为 K= |
|
| 9. | 详细信息 |
|
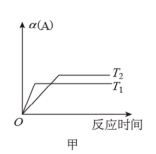
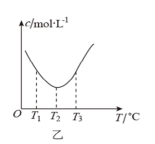
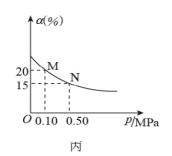
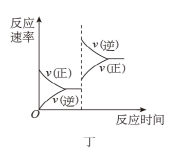
已知反应: A . 图甲中 B . 图乙中 c 表示 C . 图丙中 D . 达平衡后,降低温度,则反应速率变化图像可以用图丁表示 |
|
| 10. | 详细信息 |
|
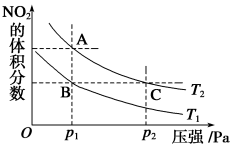
在体积恒定的密闭容器中发生反应 N 2 O 4 (g) ⇌ 2NO 2 (g) ΔH>0 ,在温度为 T 1 、 T 2 时,平衡体系中 NO 2 的体积分数随压强变化的曲线如图所示。下列说法正确的是 A . A 、 C 两点的反应速率: A>C B . A 、 C 两点气体的颜色: A 深, C 浅 C . 由状态 B 到状态 A ,可以用加热的方法 D . A 、 C 两点气体的平均相对分子质量: A>C |
|
| 11. | 详细信息 |
|
下列关于化学反应速率的说法正确个数为 ① 恒温时,增大压强,化学反应速率一定加快 ② 化学反应是活化分子有合适取向时的有效碰撞 ③ 普通分子有时也能发生有效碰撞 ④ 活化分子间的碰撞一定能发生化学反应 ⑤ 升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 ⑥ 有气体参加的化学反应,若增大压强 ( 即缩小反应容器的体积 ) ,可增加活化分子的百分数,从而使反应速率增大 ⑦ 增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 ⑧ 催化剂参与反应,能降低活化能增大活化分子的百分数,从而增大反应速率 A . 3 B . 4 C . 5 D . 6 |
|
| 12. | 详细信息 |
|
下列叙述正确的是 A . 反应 NH 3 (g)+HCl(g)=NH 4 Cl(s) 在室温下可自发进行,则该反应的 ΔH < 0 B . 反应过程的自发性可判断过程发生的速率 C . 反应物分子间发生碰撞一定能发生化学反应 D . 反应 2H 2 (g)+O 2 (g)=2H 2 O(l) 熵变 ΔS > 0 |
|
| 13. | 详细信息 |
|
我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示 ( 吸附在催化剂表面的物质用 * 表示 ) 。下列说法错误的是 A . N 2 生成 NH 3 是通过多步还原反应生成的 B . 过程 Ⅰ和Ⅲ中能量的变化不相同 C . 适当提高 N 2 分压,可以加快 N 2 (g)→*N 2 反应速率,提高 N 2 (g) 转化率 D . 大量氨分子吸附在催化剂表面,将降低反应速率 |
|
| 14. | 详细信息 |
|
对 Pd 单原子催化剂 (Pd/SVG) 上 H 2 还原 NO 的反应进行研究,发现 Pd/SVG 上 NO 被还原生成 N 2 和 NH 3 的路径机理如图所示: 下列说法正确的是 A . Pd/SVG 可以改变 NO 的平衡转化率 B . NO 被还原为 N 2 的总反应为 2NO+2H 2 =N 2 +2H 2 O C . NO 被还原为 NH 3 的反应决速步为解离 1 反应 D . Pd/SVG 上 H 2 还原 NO 过程中产物 N 2 的形成更容易 |
|
| 15. | 详细信息 |
|
使用 SNCR 脱硝技术的原理是 6NO(g)+4NH 3 (g) A . 从图 1 判断,该反应的正反应方向是放热反应 B . 从图 2 判断,减少氨气的浓度有助于提高 NO 的转化率 C . 从图 1 判断,脱硝的最佳温度约为 900 ℃ D . 从图 2 判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为 1.5-2.0 |
|
| 16. | 详细信息 |
|
下列比较中正确的是 A . 相同浓度的溶液: ①氨水、② NaOH 溶液、 ③ Ba(OH) 2 溶液 c(H + ) : ③>②>① B . 相同浓度的三种溶液: ① (NH 4 ) 2 CO 3 溶液、 ② NH 4 HCO 3 溶液、 ③ NH 4 NO 3 溶液中 c(NH C . 相同 pH 的溶液: ① CH 3 COONa 溶液、 ② NaHCO 3 溶液、 ③ NaClO 溶液中 c(Na + ) : ①>②>③ D . 同浓度、同体积的溶液: ① NaAlO 2 溶液、 ② NH 4 Cl 溶液、 ③ NaNO 3 溶液中 pH : ②>③>① |
|
| 17. | 详细信息 | ||||||||
|
已知 25 ℃时有关弱酸的电离平衡常数如下表,下列说法正确的是
A . pH 相同的 HX 、 HY 两种弱酸,其物质的量浓度: B . 相同条件下结合氢离子能力: C . 向 D . |
|||||||||
| 18. | 详细信息 | |||||||||
|
已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如表所示。
下列说法正确的是 A . 常温下,相同浓度的 B . 向 C . 向 NaClO 溶液中通入少量 D . 向氯水中分别加入等浓度的 |
||||||||||
| 19. | 详细信息 | ||||||||||||||||||||||||
|
甲醇气相脱水制甲醚的反应可表示为: 2CH 3 OH(g) ( 1 ) 一定温度下,在恒容密闭容器中充入一定量的 CH 3 OH(g) 发生上述反应,能判断反应达到化学平衡状态的是 ___________ 。 A . CH 3 OCH 3 (g) 和 H 2 O(g) 的浓度比保持不变 B . v 正 (CH 3 OH)=2v 逆 (CH 3 OCH 3 ) C . 容器内压强不再变化 D . 混合气体的平均相对分子质量不再变化 ( 2 ) 200 ℃ 时,向恒容密闭容器中充入一定量的 CH 3 OH(g) 发生上述反应,测得 CH 3 OH(g) 的浓度随时间 (t) 的变化如下表:
① 10 ~ 30 min 内,用 CH 3 OCH 3 (g) 表示该反应的平均速率为 ___________ 。 ② CH 3 OH(g) 的平衡转化率为 ___________ 。 ③反应开始时,容器内的压强为 p 0 ,第 40 min 末时容器内的压强为 p 1 ,则 p 1 ︰ p 0 = ___________ ;该反应在 200 ℃ 时的平衡常数 K p = ___________ ( 以分压表示,分压 = 总压 × 物质的量分数 ) 。 ④ 200 ℃ 时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为: v 正 (CH 3 OH) ___________ v 逆 (CH 3 OH)( 填 “ > ”“ < ” 或 “=”) 。 |
|||||||||||||||||||||||||
| 20. | 详细信息 |
|
磷元素能形成多种含氧酸。回答下列问题: ( 1 ) 次磷酸 (H 3 PO 2 ) 是一元弱酸,其在水溶液中的电离方程式为 __ 。 ( 2 ) 亚磷酸 (H 3 PO 3 ) 是二元弱酸。已知 25 ℃时, K a1 =1×10 -2 , K a2 =2.6×10 -7. ① Na 2 HPO 3 属于 __ ( 填 “ 酸式盐 ” 或 “ 正盐 ”) ; NaH 2 PO 3 溶液显 __ ( 填 “ 酸性 ”“ 碱性 ” 或 “ 中性 ”) 。 ②已知 25 ℃时, CH 3 COOH 的 K a =1.75×10 -5 ,则 CH 3 COOH 溶液和 Na 2 HPO 3 溶液反应的化学方程式为 __ 。 ( 3 ) 测定亚磷酸溶液的浓度。 取 25.00mL 亚磷酸溶液放入锥形瓶中,用 0.10mol·L -1 酸性高锰酸钾溶液进行滴定,反应的离子方程式为 __ 。 |
|
| 21. | 详细信息 |
|
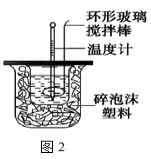
Ⅰ . 当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热较大,可用作燃料。如图 1 表示乙烷、二甲醚燃烧过程中的能量变化。 请回答下列问题: ( 1 ) a= __ 。 ( 2 ) 乙烷的燃烧热为 __ 。 ( 3 ) 根据题图写出二甲醚完全燃烧时的热化学方程式: __ 。 Ⅱ . 利用如图 2 装置测定中和热的实验步骤如下: ①用量筒量取 50mL0.25mol/L 硫酸倒入小烧杯中,测出硫酸温度; ②用另一量筒量取 50mL0.55mol/LNaOH 溶液,并用另一温度计测出其温度; ③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。 回答下列问题: ( 4 ) 大小烧杯中填充泡沫塑料的作用是 __ 。 ( 5 ) 倒入 NaOH 溶液的正确操作是 __ ( 从下列选出 ) 。 A. 一次迅速倒入 B. 分三次少量倒入 C. 沿玻璃棒缓慢倒入 ( 6 ) 使硫酸与 NaOH 溶液混合均匀的正确操作是 __ 。 |
|
| 22. | 详细信息 | ||||||
|
H 2 O 2 是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某研究小组欲探究 H 2 O 2 的性质做了如下实验: ( 1 ) 资料显示,某些金属离子对 H 2 O 2 的分解起催化作用。研究小组猜想 Fe 3+ 可以催化 H 2 O 2 分解,于是做了以下探究。请你帮助小组完成实验报告:
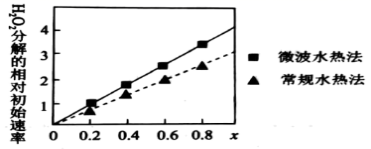
已知 FeCl 3 在水中可电离出 Fe 3+ 和 Cl - ,同学们提出以下猜想。 甲同学的猜想:真正催化 H 2 O 2 分解的是 FeCl 3 溶液中的 H 2 O ; 乙同学的猜想:真正催化 H 2 O 2 分解的是 FeCl 3 溶液中的 Fe 3+ ; 丙同学的猜想:真正催化 H 2 O 2 分解的是 FeCl 3 溶液中的 Cl - 。 你认为最不可能的是 __ 同学的猜想,理由是 __ 。 ( 2 ) 研究小组对余下的两个猜想通过实验进行了探究:向盛有 5mL5% 的 H 2 O 2 溶液的试管中加入少量的盐酸,并把带火星的木条伸入祓管,实验结果无明显现象,由此得出结论: __ 。 ( 3 ) 研究小组预测同为第四周期 VIII 族的 Co 、 Ni 也可能有相似的催化作用。查阅资料: Co x Ni (1-x) Fe 2 O 4 ( 其中 Co 、 Ni 均为 +2 价 ) 也可用作 H 2 O 2 分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂 Co x Ni (1-x) Fe 2 O 4 在 10 ℃时催化分解 5% 的 H 2 O 2 溶液的相对初始速率随 x 变化曲线。由图中信息可知 __ 法制取得到的催化剂活性更高,推测 Co 2+ 、 Ni 2+ 两种离子中催化效果更好的是 __ 。 |
|||||||