2017жұҹиҘҝй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В 2017 е№ҙдё–з•Ңең°зҗғж—ҘжҲ‘еӣҪзҡ„дё»йўҳдёәвҖңиҠӮзәҰйӣҶзәҰеҲ©з”Ёиө„жәҗ,еҖЎеҜјз»ҝиүІз®ҖзәҰз”ҹжҙ»вҖқгҖӮдёӢеҲ—еҒҡжі•еә”жҸҗеҖЎзҡ„жҳҜпјҲгҖҖгҖҖпјү A.еӨҸеӨ©и®ҫе®ҡз©әи°ғжё©еәҰе°ҪеҸҜиғҪзҡ„дҪҺВ В В В B.жҺЁе№ҝдҪҝз”ЁдёҖж¬ЎжҖ§еЎ‘ж–ҷиўӢе’Ңзәёе·ҫ C.е°‘ејҖз§Ғ家иҪҰеӨҡд№ҳе…¬е…ұдәӨйҖҡе·Ҙе…·В В В В D.еҜ№е•Ҷе“ҒиҝӣиЎҢиұӘеҚҺеҢ…иЈ…дҝғиҝӣй”Җе”®
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) A. еӨҡзі–гҖҒиӣӢзҷҪиҙЁйғҪжҳҜй«ҳеҲҶеӯҗеҢ–еҗҲзү©,дёҖе®ҡжқЎд»¶дёӢйғҪиғҪж°ҙи§Ј B. жҷ®йҖҡзҺ»з’ғгҖҒй’ўеҢ–зҺ»з’ғе’ҢжңүжңәзҺ»з’ғйғҪжҳҜзЎ…й…ёзӣҗеҲ¶е“Ғ C. еҲҶйҰҸгҖҒе№ІйҰҸйғҪжҳҜзү©зҗҶеҸҳеҢ–пјҢиЈӮеҢ–гҖҒиЈӮи§ЈйғҪжҳҜеҢ–еӯҰеҸҳеҢ– D. е°јйҫҷз»ігҖҒзҫҠз»’иЎ«е’ҢжЈүиЎ¬иЎЈзӯүз”ҹжҙ»з”Ёе“ҒйғҪжҳҜз”ұеҗҲжҲҗзәӨз»ҙеҲ¶йҖ зҡ„
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҘдёӢеҸҚеә”жңҖз¬ҰеҗҲз»ҝиүІеҢ–еӯҰеҺҹеӯҗз»ҸжөҺжҖ§иҰҒжұӮзҡ„жҳҜпјҲВ В В В пјү A.з”ЁSiO2еҲ¶еӨҮй«ҳзәҜзЎ…В В В В В В B.д№ҷзғҜиҒҡеҗҲдёәиҒҡд№ҷзғҜй«ҳеҲҶеӯҗжқҗж–ҷ C.е·Ҙдёҡз……зғ§зҹізҒ°зҹіеҲ¶ CaOВ В В D.д»Ҙй“ңе’Ңжө“зЎқй…ёдёәеҺҹж–ҷз”ҹдә§зЎқй…ёй“ң
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”еҺҹзҗҶдёҚз¬ҰеҗҲе·ҘдёҡеҶ¶зӮјйҮ‘еұһе®һйҷ…жғ…еҶөзҡ„жҳҜпјҲВ В В В пјү AпјҺ2HgO CпјҺ2MgO
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
жӯЈзЎ®жҺҢжҸЎеҢ–еӯҰз”ЁиҜӯжҳҜеӯҰеҘҪеҢ–еӯҰзҡ„еҹәзЎҖпјҢдёӢеҲ—жңүе…іиЎЁиҝ°жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺHгҖҒDгҖҒTдә’дёәеҗҢзҙ ејӮеҪўдҪ“В В В В В В В BпјҺиҙЁйҮҸж•°дёә31зҡ„зЈ·еҺҹеӯҗпјҡ CпјҺж¬Ўж°Ҝй…ёзҡ„з”өеӯҗејҸпјҡ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲҶзҰ»жҸҗзәҜж–№жі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В пјҲВ В В пјү AпјҺйҷӨеҺ»д№ҷйҶҮдёӯе°‘йҮҸзҡ„ж°ҙпјҢеҠ е…Ҙж–°еҲ¶зҡ„з”ҹзҹізҒ°пјҢиҝҮж»Ө BпјҺжҸҗзәҜеҗ«жңүзўҳеҚ•иҙЁзҡ„йЈҹзӣҗпјҢеёёз”ЁеҚҮеҚҺжі• CпјҺйҷӨеҺ»д№ҷй…ёд№ҷй…Ҝдёӯзҡ„д№ҷй…ёпјҢеҸҜеҠ е…ҘNaOHжә¶ж¶ІеҗҺеҲҶж¶І DпјҺеҲҶзҰ»иӢҜе’Ңй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІпјҢи’ёйҰҸ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
NAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В В ) AпјҺ0.5molзҫҹеҹәдёӯжүҖеҗ«з”өеӯҗж•°дёә5NA BпјҺ1molиӢҜд№ҷзғҜпјҲ CпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2Lзҡ„дәҢж°Ҝз”Ізғ·жүҖеҗ«зҡ„еҲҶеӯҗж•°дёә0.5NA DпјҺеёёжё©дёӢпјҢ7.8 gNa2O2дёӯеҗ«жңүзҡ„зҰ»еӯҗжҖ»ж•°дёә0.3NA
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢдёӯпјҢдёҚиғҪи§ӮеҜҹеҲ°жҳҺжҳҫеҸҳеҢ–зҡ„жҳҜпјҲ В В В В пјү A.жҠҠдёҖж®өжү“зЈЁиҝҮзҡ„й•ҒеёҰж”ҫе…Ҙе°‘йҮҸж°ҙдёӯВ B.жҠҠCl2йҖҡе…ҘFeCl2жә¶ж¶Ідёӯ C.жҠҠз»ҝиұҶеӨ§е°Ҹзҡ„й’ҫжҠ•е…Ҙе°‘йҮҸж°ҙдёӯВ В В В В D.жҠҠжәҙж°ҙж»ҙеҠ еҲ°ж·ҖзІүKIжә¶ж¶Ідёӯ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү A.1molзҡ„зЎ«и’ёжұҪе’ҢзЎ«еӣәдҪ“еҲҶеҲ«е®Ң全然зғ§пјҢеүҚиҖ…в–іHжҜ”еҗҺиҖ…е°Ҹ B.еңЁ101kPaж—¶пјҢ1molзўізҮғзғ§жүҖж”ҫеҮәзҡ„зғӯйҮҸдёәзўізҡ„зҮғзғ§зғӯ C.з”ұC(s,зҹіеўЁ)в•җC(s,йҮ‘еҲҡзҹі)пјӣв–іH=+1.9kJвҖўmol-1 еҸҜзҹҘпјҢйҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ D.еҸҚеә”зғӯе°ұжҳҜеҸҚеә”дёӯж”ҫеҮәзҡ„иғҪйҮҸ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ WгҖҒXгҖҒYе’ҢZеңЁе‘ЁжңҹиЎЁдёӯзҡ„зӣёеҜ№дҪҚзҪ®еҰӮиЎЁжүҖзӨәпјҢиҝҷеӣӣз§Қе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә21гҖӮдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜВ пјҲВ В В В В пјү AпјҺз®ҖеҚ•зҰ»еӯҗзҡ„еҚҠеҫ„пјҡY>XВ В В В В В В В В В В BпјҺж°ўеҢ–зү©жІёзӮ№пјҡW<ZВ В В В В CпјҺж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§пјҡY<WВ В DпјҺеҢ–еҗҲзү©зҶ”зӮ№пјҡY2X3<YZ3
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
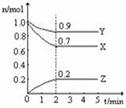
H2е’ҢI2еңЁдёҖе®ҡжқЎд»¶дёӢиғҪеҸ‘з”ҹеҸҚеә”пјҡH2пјҲgпјү+I2пјҲgпјү
AпјҺиҜҘеҸҚеә”дёәеҗёзғӯеҸҚеә” BпјҺж–ӯејҖ2 mol HIеҲҶеӯҗдёӯзҡ„еҢ–еӯҰй”®жүҖйңҖиғҪйҮҸзәҰдёә(c+b+a)kJ CпјҺеҸҚеә”зү©зҡ„жҖ»иғҪйҮҸдҪҺдәҺз”ҹжҲҗзү©зҡ„жҖ»иғҪйҮҸ DпјҺеҗ‘еҜҶй—ӯе®№еҷЁдёӯеҠ е…Ҙ2 mol H2пјҲgпјүе’Ң2 mol I2пјҲgпјүпјҢе……еҲҶеҸҚеә”еҗҺж”ҫеҮәзҡ„зғӯйҮҸдёә2a kJ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҰӮеӣҫжүҖзӨәдёәжңүе…іиӢҜзҡ„иҪ¬еҢ–е…ізі»еӣҫ,дёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү A.еҸҚеә”в‘ гҖҒв‘ўеқҮдёәеҸ–д»ЈеҸҚеә” B.еҸҚеә”в‘Ўзҡ„зҺ°иұЎжҳҜзҒ«з„°жҳҺдә®е№¶еёҰжңүжө“зғҹ C.еҸҚеә”в‘Јзҡ„дә§зү©дёӯжүҖжңүеҺҹеӯҗеңЁеҗҢдёҖе№ійқўдёҠ D.з”ІиӢҜ(
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
A.иҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә3X+Y B.е®№еҷЁеҶ…ж··еҗҲж°”дҪ“зҡ„е№іеқҮж‘©е°”иҙЁйҮҸдҝқжҢҒдёҚеҸҳиЎЁ C.е№іиЎЎж—¶пјҢдҪ“зі»зҡ„еҺӢејәжҳҜејҖе§Ӣж—¶зҡ„1.8еҖҚ D.е№іиЎЎж—¶пјҢYзҡ„дҪ“з§ҜеҲҶж•°дёә50пј…
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
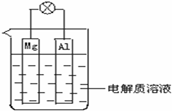
дёҖз§ҚеҹәдәҺй…ёжҖ§зҮғж–ҷз”өжұ еҺҹзҗҶи®ҫи®Ўзҡ„й…’зІҫжЈҖжөӢд»ӘпјҢиҙҹжһҒдёҠзҡ„еҸҚеә”дёәпјҡCH3CH2OHп№Ј4eп№Ј+H2O=CH3COOH+4H+пјҺдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү AпјҺжЈҖжөӢж—¶пјҢз”өи§ЈиҙЁжә¶ж¶Ідёӯзҡ„H+еҗ‘иҙҹжһҒ移еҠЁВ BпјҺд№ҷйҶҮжүҖеңЁзҡ„з”өжһҒеҸ‘з”ҹдәҶж°§еҢ–еҸҚеә” CпјҺиӢҘжңү0.4molз”өеӯҗиҪ¬з§»пјҢеҲҷеңЁж ҮеҮҶзҠ¶еҶөдёӢж¶ҲиҖ—4.48Lж°§ж°” DпјҺжӯЈжһҒдёҠеҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡO2+4eп№Ј+2H2O=4OHп№Ј
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
1molд№ҷзғҜдёҺHClе®Ңе…ЁеҠ жҲҗеҗҺеҶҚдёҺCl2еҪ»еә•еҸ–д»ЈпјҢж¶ҲиҖ—ж°Ҝж°”зҡ„зү©иҙЁзҡ„йҮҸжҳҜпјҲВ В В В пјү A.2 molВ В В В В B. 2.5molВ В В В В C.4molВ В В В В D. 5molВ В В В В В
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
BпјҺжә¶ж¶Ій…ёжҖ§и¶ҠејәпјҢRзҡ„йҷҚи§ЈйҖҹзҺҮи¶Ҡе°Ҹ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||||||||||||||||
|
дёӢиЎЁжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢеӣһзӯ”дёӢеҲ—жңүе…ій—®йўҳпјҡ
(1)еҶҷеҮәе…ғзҙ в‘©з¬ҰеҸ·пјҡгҖҖ гҖҖВ В В В В В В В пјӣз”»еҮәеҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡв‘ҰгҖҖ гҖҖВ В В В В В В пјҺ (2)д»Һв‘ӨеҲ°в‘Ёе…ғзҙ дёӯйқһйҮ‘еұһжҖ§иҫғејәзҡ„е…ғзҙ жҳҜгҖҖ гҖҖВ В В В В пјҲз”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨәпјүпјҢиҝҷдәӣе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯзўұжҖ§жңҖејәзҡ„жҳҜ гҖҖ гҖҖВ В В В В В В (еЎ«еҢ–еӯҰејҸ)В В В (3)еҶҷеҮәе…ғзҙ в‘Јж°ўеҢ–зү©зҡ„з”өеӯҗејҸпјҡгҖҖ гҖҖВ В В В В В В В В В В В В (4)еҶҷеҮәдёҖз§Қз”ұв‘ гҖҒв‘ўгҖҒв‘Јдёүз§Қе…ғзҙ еҪўжҲҗзҡ„еёёи§ҒзҰ»еӯҗеҢ–еҗҲзү©пјҡгҖҖ гҖҖгҖҖ гҖҖ В В В В В (5)з”Ёз”өеӯҗејҸиЎЁзӨәв‘ҘгҖҒв‘ЁеҪўжҲҗеҢ–еҗҲзү©зҡ„иҝҮзЁӢпјҡгҖҖ гҖҖгҖҖ гҖҖгҖҖ гҖҖгҖҖ гҖҖгҖҖ гҖҖВ
|
||||||||||||||||||||||||||||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||
|
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)з”ұдәҺжәҙзҰ»еӯҗеңЁжө·ж°ҙдёӯжө“еәҰеҫҲдҪҺпјҲ0.067g/LпјүпјҢиҰҒиҝӣиЎҢжәҙе…ғзҙ зҡ„жө“зј©гҖҒеҜҢйӣҶгҖӮе®һйӘҢе®ӨиӢҘиҰҒзӣҙжҺҘжө“зј©жө·ж°ҙж—¶пјҢдёӢйқўзҡ„д»ӘеҷЁ AпјҺзҺ»з’ғжЈ’В В BпјҺдёүи„ҡжһ¶В В CпјҺеқ©еҹҡВ В В DпјҺи’ёеҸ‘зҡҝВ В В EпјҺй…’зІҫзҒҜ (2)иҰҒзҹҘйҒ“жө·ж°ҙжҷ’зӣҗзҡ„иҝҮзЁӢдёӯжә¶ж¶ІйҮҢйЈҹзӣҗеҗ«йҮҸеңЁйҖҗжёҗжҸҗй«ҳзҡ„з®Җжҳ“ж–№жі•жҳҜ___________гҖӮ AпјҺеҲҶжһҗж°ҜеҢ–й’ еҗ«йҮҸВ В В BпјҺжөӢе®ҡжә¶ж¶ІеҜҶеәҰВ В В CпјҺи§ӮеҜҹжҳҜеҗҰжңүжІүж·ҖжһҗеҮә (3)еҶҷеҮәжәҙж°ҙдёӯйҖҡе…ҘSO2ж—¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ____________ (4)дёҠеӣҫдёӯиҷҡзәҝжЎҶеҶ…жөҒзЁӢд№ҹеҸҜз”Ё ____Br2 + _____Na2CO3 = _____NaBrO3 +___________ +________В (5)зҺ°жңүдёҖд»Ҫеҗёж”¶дәҶжәҙзҡ„ж— иүІжә¶ж¶І(йҮҮз”ЁдёҠиҝ°дёӨз§Қж–№жі•д№ӢдёҖпјҢдё”еҗёж”¶еүӮе’ҢжәҙжҒ°еҘҪе®Ңе…ЁеҸҚеә”)пјҢиҜ·дҪ йҖҡиҝҮе®һйӘҢжҺўз©¶иҜҘжә¶ж¶Із©¶з«ҹжҳҜйҮҮз”ЁйӮЈз§Қж–№жі•еҗёж”¶жәҙзҡ„гҖӮ в‘ жҸҗеҮәеҗҲзҗҶеҒҮи®ҫ еҒҮи®ҫ1пјҡйҮҮз”ЁзәҜзўұеҗёж”¶жі•пјҢеҗёж”¶ж¶Ідёӯеҗ«еӨ§йҮҸNa+гҖҒBr вҖ“гҖҒBrO3-В В В еҒҮи®ҫ2пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘Ў и®ҫи®Ўж–№жЎҲгҖҒиҝӣиЎҢе®һйӘҢпјҢйӘҢиҜҒеҒҮи®ҫпјҡиҜ·еңЁиЎЁдёӯеҶҷеҮәе®һйӘҢжӯҘйӘӨд»ҘеҸҠйў„жңҹзҺ°иұЎе’Ңз»“и®әгҖӮйҷҗйҖүе®һйӘҢиҜ•еүӮе’Ңд»ӘеҷЁпјҡ10mLйҮҸзӯ’гҖҒе°Ҹзғ§жқҜгҖҒиҜ•з®ЎгҖҒиғ¶еӨҙж»ҙз®Ўпјӣж— ж°ҙд№ҷйҶҮгҖҒиӢҜгҖҒ0.10mol/LAgNO3гҖҒ0.10mol/LBaCl2гҖҒ2mol/LHClВ В В В жҹҘиө„ж–ҷеҫ—пјҡBa(BrO3)2дёәзҷҪиүІеӣәдҪ“пјҢеҫ®жә¶дәҺж°ҙ
|
|||||||||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
д»Ҙж·ҖзІүAдёәеҺҹж–ҷеҸҜд»ҘеҲ¶еҫ—жңүиҢүиҺүиҠұйҰҷе‘ізҡ„HпјҢзҺ°жҢүд»ҘдёӢж–№ејҸиҝӣиЎҢеҗҲжҲҗиҜҘйҰҷж–ҷпјҲж–№жЎҶдёӯAгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFеқҮдёәжңүжңәзү©пјҢеҗҢж—¶ж–№жЎҶдёӯжҹҗдәӣж— жңәдә§зү©зңҒз•Ҙпјү е·ІзҹҘпјҡRCH2ClпјӢNaOH В В В E C2H4O2 В В В B C6H12O6 иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүAзҡ„еҢ–еӯҰејҸдёә______пјҢBзҡ„еҗҚз§°дёә______гҖӮ пјҲ2пјүеҶҷеҮәв‘ в‘Ўзҡ„еҸҚеә”зұ»еһӢпјҡв‘ ______пјҢв‘Ў______гҖӮ пјҲ3пјүCвҶ’Dзҡ„еҢ–еӯҰж–№зЁӢејҸдёә______________________________пјҢ пјҲ4пјүF+EвҶ’Hзҡ„еҢ–еӯҰж–№зЁӢејҸдёә____________________________пјҢ пјҲ5пјүиҠійҰҷеҢ–еҗҲзү©XжҳҜHзҡ„еҗҢеҲҶејӮжһ„дҪ“пјҢXиғҪдёҺйҘұе’Ңзўій…ёж°ўй’ жә¶ж¶ІеҸҚеә”
|
|||||
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ6.48gеҗ«жңүCгҖҒHгҖҒOзҡ„жңүжңәзү©M,иЈ…е…Ҙе…ғзҙ еҲҶжһҗиЈ…зҪ®,йҖҡе…Ҙи¶ійҮҸзҡ„O2дҪҝе®ғе®Ңе…ЁзҮғзғ§,е°Ҷз”ҹжҲҗзҡ„ж°”дҪ“дҫқж¬ЎйҖҡиҝҮж°ҜеҢ–й’ҷе№ІзҮҘз®ЎAе’ҢзўұзҹізҒ°е№ІзҮҘз®ЎB.жөӢеҫ—Aз®ЎиҙЁйҮҸеўһеҠ дәҶ4.32g,Bз®ЎеўһеҠ дәҶ18.48gпјҢе·ІзҹҘиҜҘжңүжңәзү©зҡ„зӣёеҜ№еҲҶ В |
|
- жіёж°ҙдә”дёӯ2018е№ҙй«ҳдәҢеүҚеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝзӯ”йўҳ
- жІіеҢ—е®үе№ідёӯеӯҰй«ҳдёҖеҢ–еӯҰ2019е№ҙдёӢеҶҢжңҹдёӯиҖғиҜ•е®Ңж•ҙиҜ•еҚ·
- е®үеҫҪзңҒж»Ғе·һеёӮе®ҡиҝңеҺҝиӮІжүҚеӯҰж Ў2020-2021е№ҙй«ҳдёҖдёҠжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- еұұиҘҝ2018е№ҙй«ҳдёҖдёӢеҚҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢеёҰзӯ”жЎҲдёҺи§Јжһҗ
- е®ҒеӨҸйқ’й“ңеіЎеёӮй«ҳзә§дёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғ
- 2020еұҠй«ҳдёүеҢ–еӯҰйҖүдҝ®дёүдәҢиҪ®дё“йўҳеӨҚд№ --е…ұд»·й”®гҖҒе…ұд»·еҢ–еҗҲзү©
- й»‘йҫҷжұҹ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдёҖдёӢеҶҢжңҹжң«ж•ҷеӯҰиҙЁйҮҸжөӢиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиҘҝзңҒдёҠйҘ¶еёӮпјү