2021е№ҙжұҹиӢҸзңҒж— й”ЎеёӮдёӯиҖғеҢ–еӯҰзңҹйўҳеҗ«зӯ”жЎҲи§Јжһҗ
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖң еҘӢж–—иҖ…еҸ· вҖқ иҪҪдәәжҪңж°ҙеҷЁйҮҮз”Ёж–°еһӢй’ӣеҗҲйҮ‘дҪңдёәиҲұеЈіжқҗж–ҷгҖӮй’ӣеҗҲйҮ‘еұһдәҺ A пјҺ йҮ‘еұһжқҗж–ҷ B пјҺ йқһйҮ‘еұһжқҗж–ҷ C пјҺ еҗҲжҲҗжқҗж–ҷ D пјҺ еӨҚеҗҲжқҗж–ҷ |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
жө·ж°ҙдёӯеҗ«йҮҸжңҖй«ҳзҡ„е…ғзҙ жҳҜ A пјҺ H B пјҺ O C пјҺ Na D пјҺ Cl |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺзәҜеҮҖзү©зҡ„жҳҜ A пјҺ зҹҝжіүж°ҙ B пјҺ йҮ‘еҲҡзҹі C пјҺ дёҚй”Ҳй’ў D пјҺ еҸҜзҮғеҶ° |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁж”ҫе…Ҙж°ҙдёӯиғҪеҪўжҲҗжә¶ж¶Ізҡ„жҳҜ A пјҺ и”—зі– B пјҺ жұҪжІ№ C пјҺ йқўзІү D пјҺ жіҘжІҷ |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йЈҹе“ҒеҸҜдҪңдёәдәәдҪ“иҺ·еҸ–з»ҙз”ҹзҙ дё»иҰҒжқҘжәҗзҡ„жҳҜ A пјҺ д№ҢзұійҘӯ B пјҺ ж°ҙиңңжЎғ C пјҺ й…ұжҺ’йӘЁ D пјҺ 马蹄й…Ҙ |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
иҮӘжқҘж°ҙеҺӮеҮҖж°ҙиҝҮзЁӢдёӯдёҚеёёз”Ёзҡ„ж–№жі•жҳҜ A пјҺ жІүж·Җ B пјҺ иҝҮж»Ө C пјҺ еҗёйҷ„ D пјҺ и’ёйҰҸ |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯдёӯж•°еӯ— вҖң2вҖқ иЎЁзӨәзҡ„ж„Ҹд№үжӯЈзЎ®зҡ„жҳҜ A пјҺ 2HвҖ”вҖ”2 дёӘж°ўе…ғзҙ B пјҺ O 2 вҖ”вҖ”2 дёӘж°§еҺҹеӯҗ C пјҺ 2COвҖ”вҖ”2 дёӘдёҖж°§еҢ–зўіеҲҶеӯҗ D пјҺ Fe 2+ вҖ”вҖ”1 дёӘй“ҒзҰ»еӯҗеёҰ 2 дёӘеҚ•дҪҚжӯЈз”өиҚ· |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
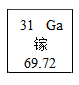
1875 е№ҙпјҢеёғз“ҰеҚҡеҫ·жң—еҲ©з”Ёе…үи°ұеҲҶжһҗеңЁй—Әй”ҢзҹҝдёӯеҸ‘зҺ°дәҶй•“пјҢй—ЁжҚ·еҲ—еӨ«йў„иЁҖзҡ„ вҖң зұ»й“қ вҖқ е…ғзҙ еҫ—еҲ°дәҶиҜҒе®һгҖӮеҰӮеӣҫжҳҜй•“е…ғзҙ еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҝЎжҒҜгҖӮдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ A пјҺ й•“жҳҜдёҖз§ҚйҮ‘еұһе…ғзҙ B пјҺ й•“зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸжҳҜ 69.72g C пјҺ й•“еҺҹеӯҗдёӯзҡ„иҙЁеӯҗж•°жҳҜ 31 D пјҺ й•“дёҺй“қзҡ„жҖ§иҙЁзӣёдјј |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҷж°Ёй…ёпјҲ C 3 H 7 O 2 N пјүжҳҜдёҖз§Қеёёи§Ғзҡ„ж°Ёеҹәй…ёгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A пјҺ дёҷж°Ёй…ёеұһдәҺжңүжңәе°ҸеҲҶеӯҗеҢ–еҗҲзү© B пјҺ дёҷж°Ёй…ёжҳҜдёҖз§ҚиӣӢзҷҪиҙЁ C пјҺ жҜҸдёӘдёҷж°Ёй…ёеҲҶеӯҗдёӯеҗ«жңү 1 дёӘж°§еҲҶеӯҗ D пјҺ дёҷж°Ёй…ёдёӯзўігҖҒж°®е…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә 3 пјҡ 1 |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„жҖ§иҙЁдёҺз”ЁйҖ”еҜ№еә”е…ізі»жӯЈзЎ®зҡ„жҳҜ A пјҺ зҹіеўЁжңүеҜјз”өжҖ§пјҢеҸҜз”ЁдәҺз”ҹдә§й“…笔иҠҜ B пјҺ 银жңүйҮ‘еұһе…үжіҪпјҢеҸҜз”ЁдәҺеҲ¶йҖ з”өзәҝ C пјҺ дәҢж°§еҢ–зўіиғҪдёҺж°ҙеҸҚеә”пјҢеҸҜз”ЁдәҺзҒӯзҒ« D пјҺ зҶҹзҹізҒ°жә¶ж¶ІжңүзўұжҖ§пјҢеҸҜз”ЁдәҺж”№иүҜй…ёжҖ§еңҹеЈӨ |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
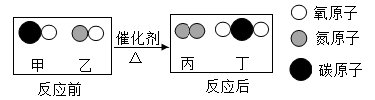
еҰӮеӣҫжҳҜз”Іе’Ңд№ҷеңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”еүҚеҗҺеҲҶеӯҗз§Қзұ»еҸҳеҢ–зҡ„еҫ®и§ӮзӨәж„ҸеӣҫгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A пјҺ з”ІдёҺдёҷеқҮеұһдәҺж°§еҢ–зү© B пјҺ еҸҚеә”з”ҹжҲҗзҡ„дёҷдёҺдёҒзҡ„еҲҶеӯҗдёӘж•°жҜ”дёә 1 пјҡ 1 C пјҺ еҸҚеә”еҗҺеҺҹеӯҗзҡ„ж•°зӣ®еўһеҠ D пјҺ иҜҘеҸҚеә”иғҪдҪҝжңүе®іж°”дҪ“иҪ¬еҢ–дёәж— е®ізү©иҙЁ |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A пјҺ е®һйӘҢе®ӨеҲ¶еҸ– O 2 пјҡ 2KMnO 4 в•җK 2 MnO 4 +MnO 2 +O 2 вҶ‘ B пјҺ е·ҘдёҡдёҠеҲҶзҰ»ж¶ІжҖҒз©әж°”еҫ—еҲ° O 2 зҡ„еҸҳеҢ–еұһдәҺеҢ–еӯҰеҸҳеҢ– C пјҺ иҮӘ然з•ҢдёӯжӨҚзү©йҖҡиҝҮе…үеҗҲдҪңз”Ёеҗёж”¶ CO 2 пјҢйҮҠж”ҫ O 2 D пјҺ дәәдҪ“е‘јеҮәзҡ„ж°”дҪ“дёӯ CO 2 зҡ„еҗ«йҮҸжҜ” O 2 й«ҳ |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
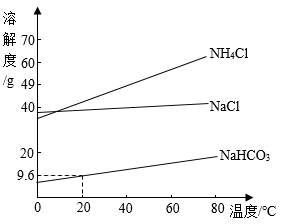
вҖң дҫҜж°ҸеҲ¶зўұжі• вҖқ з”ҹдә§зәҜзўұзҡ„дё»иҰҒеҸҚеә”жҳҜ NaCl+NH 4 HCO 3 в•җNaHCO 3 вҶ“+NH 4 Cl гҖӮеҰӮеӣҫжҳҜдёүз§Қзү©иҙЁзҡ„жә¶и§ЈеәҰжӣІзәҝгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A пјҺ 0в„ғ ж—¶пјҢ NH 4 Cl зҡ„жә¶и§ЈеәҰеӨ§дәҺ NaCl зҡ„жә¶и§ЈеәҰ B пјҺ 20в„ғ ж—¶пјҢ NaHCO 3 йҘұе’Ңжә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёҖе®ҡеӨ§дәҺ NH 4 Cl дёҚйҘұе’Ңжә¶ж¶Ідёӯжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•° C пјҺ 20в„ғ ж—¶пјҢ 100g ж°ҙдёӯеҠ е…Ҙ 5.85g NaCl е’Ң 7.9g NH 4 HCO 3 еӣәдҪ“пјҢиӮҜе®ҡжңү NaHCO 3 жҷ¶дҪ“жһҗеҮә D пјҺ NH 4 Cl еӣәдҪ“дёӯеҗ«жңүе°‘йҮҸзҡ„ NaCl пјҢеҸҜз”ЁйҷҚжё©з»“жҷ¶зҡ„ж–№жі•жҸҗзәҜ NH 4 Cl |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еҲ©з”ЁеҰӮеӣҫиЈ…зҪ®иҝӣиЎҢзҮғзғ§жқЎд»¶зҡ„жҺўз©¶гҖӮиҜ•з®Ў в‘ дёӯе……ж»Ўж°®ж°”пјҢиҜ•з®Ўв‘Ўв‘ўдёӯе……ж»Ўж°§ж°”пјҢеҚҮжё©иҮі 40в„ғ пјҢд»…и§ӮеҜҹеҲ° в‘Ўдёӯзҡ„зҷҪзЈ·зҮғзғ§гҖӮдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ A пјҺ з”ұе®һйӘҢ в‘ в‘ЎеҸҜйӘҢиҜҒзҮғзғ§йңҖиҰҒж°§ж°” B пјҺ з”ұе®һйӘҢ в‘Ўв‘ўеҸҜжҺЁзҹҘзқҖзҒ«зӮ№й«ҳдҪҺпјҡзәўзЈ·пјһзҷҪзЈ· C пјҺ еҲ©з”Ёж°ҙжөҙжҺ§жё©еҸҜи°ғиҠӮеҸҜзҮғзү©зҡ„зқҖзҒ«зӮ№ D пјҺ в‘ в‘ўдёӨж”ҜиҜ•з®ЎеҶ…зҡ„зҷҪзЈ·е’ҢзәўзЈ·еҸҜеӣһ收еҶҚеҲ©з”Ё |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ 0.72g иҚүй…ёдәҡй“ҒпјҲ FeC 2 O 4 пјүж”ҫеңЁдёҖдёӘеҸҜз§°йҮҸзҡ„ж•һеҸЈе®№еҷЁдёӯй«ҳжё©з„ҷзғ§пјҢ 500 пҪһ 600в„ғ ж—¶пјҢе®№еҷЁдёӯзҡ„еӣәдҪ“иҙЁйҮҸдҝқжҢҒ 0.4g дёҚеҸҳгҖӮжүҖеҫ—зү©иҙЁзҡ„еҢ–еӯҰејҸдёә A пјҺ Fe B пјҺ FeO C пјҺ Fe 2 O 3 D пјҺ Fe 3 O 4 |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
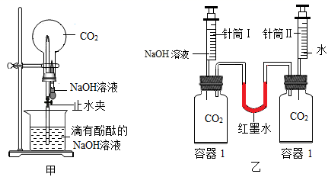
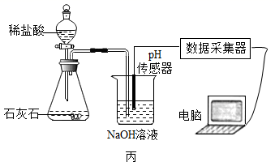
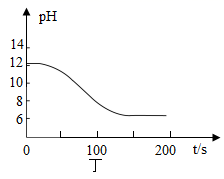
еҢ–еӯҰе…ҙи¶Је°Ҹз»„еҜ№ CO 2 дёҺ NaOH жә¶ж¶ІеҸҚеә”зҡ„еҸ‘з”ҹиҝӣиЎҢдәҶжҺўз©¶гҖӮ пјҲ 1 пјү д»ҺеҺӢејәеҸҳеҢ–зҡ„и§’еәҰжҺўз©¶гҖӮ в‘ еҲ©з”Ёеӣҫз”ІиЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҢе…ҲжҢӨеҺӢиғ¶еӨҙж»ҙз®ЎпјҢеҶҚжү“ејҖжӯўж°ҙеӨ№пјҢи§ӮеҜҹеҲ°зғ§з“¶еҶ…еҪўжҲҗзәўиүІ вҖң е–·жіү вҖқ пјҢеҺҹеӣ жҳҜзғ§з“¶еҶ…еҺӢејә _____ пјҲеЎ« вҖң еӨ§дәҺ вҖқ жҲ– вҖң е°ҸдәҺ вҖқ пјүеӨ–з•ҢеӨ§ж°”еҺӢпјӣ в‘ЎеҲ©з”Ёеӣҫд№ҷиЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҢеҲҶеҲ«е°ҶзӯүдҪ“з§Ҝзҡ„ NaOH жә¶ж¶Іе’Ңж°ҙеҗҢж—¶жіЁе…ҘзӣӣжңүзӯүдҪ“з§Ҝ CO 2 зҡ„зҺ»з’ғе®№еҷЁдёӯгҖӮиҜҒжҳҺ CO 2 дёҺ NaOH жә¶ж¶ІеҸ‘з”ҹеҸҚеә”зҡ„е®һйӘҢзҺ°иұЎжҳҜ ____ пјӣ в‘ўеҶҷеҮә CO 2 дёҺ NaOH жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ _____ гҖӮ пјҲ 2 пјү еҲ©з”Ё вҖң ж•°еӯ—еҢ–е®һйӘҢ вҖқ жҺўз©¶гҖӮ в‘ еҶҷеҮәеӣҫдёҷдёӯеҲ¶еҸ– CO 2 зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ _____ пјҢжЈҖйӘҢ CO 2 зҡ„ж–№жі•жҳҜ _____ пјӣ в‘Ўе®һйӘҢжөӢеҫ—зғ§жқҜдёӯжә¶ж¶Ізҡ„ pH йҡҸж—¶й—ҙзҡ„еҸҳеҢ–е…ізі»еҰӮеӣҫдёҒжүҖзӨәпјҢеҸҜжҺЁзҹҘеҸҚеә”иҝҮзЁӢдёӯжө“еәҰдёҚж–ӯеҮҸе°Ҹзҡ„зҰ»еӯҗжҳҜ _____ пјҲеЎ«зҰ»еӯҗз¬ҰеҸ·пјүгҖӮ пјҲ 3 пјү ж°Ҝзўұе·Ҙдёҡз”ҹдә§зҡ„зғ§зўұж ·е“Ғдёӯеёёеҗ«жңү Na 2 CO 3 е’Ң NaCl зӯүжқӮиҙЁгҖӮдёәжөӢе®ҡзғ§зўұж ·е“Ғдёӯ Na 2 CO 3 зҡ„иҙЁйҮҸеҲҶж•°пјҢз§°еҸ– 20g зғ§зўұж ·е“ҒпјҢеҠ и¶ійҮҸж°ҙжә¶и§ЈпјҢеҶҚеҠ е…Ҙи¶ійҮҸзҡ„ BaCl 2 жә¶ж¶ІпјҢе……еҲҶеҸҚеә”еҗҺпјҢиҝҮж»ӨпјҢе°Ҷж»ӨжёЈжҙ—ж¶ӨгҖҒе№ІзҮҘгҖҒз§°йҮҸпјҢеҫ—еҲ° 0.197g зўій…ёй’ЎпјҲ BaCO 3 пјүеӣәдҪ“гҖӮ в‘ жЈҖйӘҢзғ§зўұж ·е“ҒдёӯжҳҜеҗҰеҗ«жңү Na 2 CO 3 пјҢеҸҜйҖүжӢ©зҡ„иҜ•еүӮжҳҜ ____ пјҲеЎ«еӯ—жҜҚпјүпјӣ a пјҺзЁҖзӣҗй…ё b пјҺжҫ„жё…зҹізҒ°ж°ҙ c пјҺй…ҡй…һ в‘Ўи®Ўз®—зғ§зўұж ·е“Ғдёӯ Na 2 CO 3 зҡ„иҙЁйҮҸеҲҶж•° ____ пјҲеҶҷеҮәи®Ўз®—иҝҮзЁӢпјүгҖӮ |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
й“ңеҸҠе…¶еҢ–еҗҲзү©еңЁз”ҹжҙ»гҖҒз”ҹдә§дёӯз”ЁйҖ”е№ҝжіӣгҖӮ пјҲ 1 пјү д»Ҙж°§еҢ–й“ңдёәеҺҹж–ҷеҲ¶еҸ–й“ңгҖӮ жҹҗз ”з©¶е°Ҹз»„дёәжҺўз©¶ CO зҡ„иҝҳеҺҹжҖ§пјҢи®ҫи®ЎдәҶеҰӮдёӢзі»еҲ—е®һйӘҢгҖӮ е®һйӘҢ 1 пјҡе°Ҷ CuO еҠ ж°ҙеҲ¶жҲҗзіҠзҠ¶пјҢеҲ·еңЁиҜ•з®ЎеҶ…еЈҒпјҢеңЁиҜ•з®Ўеә•йғЁеҠ е…ҘзӮӯзІүпјҢеҶҚеҗ‘иҜ•з®ЎдёӯйҖҡе…Ҙ CO 2 пјҲи§Ғеӣҫз”ІпјүпјҢйӣҶж»ЎеҗҺз«ӢеҚіз”Ёж°”зҗғеҜҶе°ҒгҖӮ е®һйӘҢ 2 пјҡз”Ёй…’зІҫзҒҜеҠ зғӯ CuO йғЁдҪҚпјҲи§Ғеӣҫд№ҷпјүпјҢж— жҳҺжҳҫзҺ°иұЎгҖӮ е®һйӘҢ 3 пјҡз”ЁеҠ зҪ‘зҪ©зҡ„й…’зІҫзҒҜеҠ зғӯзӮӯзІүпјҲи§ҒеӣҫдёҷпјүпјӣдёҖж®өж—¶й—ҙеҗҺпјҢеҲ©з”Ё CO 2 дј ж„ҹеҷЁжөӢеҫ—иҜ•з®ЎеҶ… CO 2 еҗ«йҮҸеҸҳе°ҸгҖӮ е®һйӘҢ 4 пјҡеҠ зғӯ CuO пјҲи§ҒеӣҫдёҒпјүпјҢй»‘иүІеӣәдҪ“еҸҳжҲҗзҙ«зәўиүІгҖӮ в‘ е®һйӘҢ 1 дёӯжө“зЎ«й…ёзҡ„дҪңз”ЁжҳҜ ________ пјӣ в‘Ўе®һйӘҢ 2 еҫ—еҲ°зҡ„з»“и®әжҳҜ _______ пјӣ в‘ўе®һйӘҢ 3 зҡ„зӣ®зҡ„жҳҜ _______ пјҢй…’зІҫзҒҜеҠ зҪ‘зҪ©зҡ„дҪңз”ЁжҳҜ ________ пјӣ в‘ЈеҶҷеҮәе®һйӘҢ 4 дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ ________ гҖӮ пјҲ 2 пјү д»Ҙиҫүй“ңзҹҝпјҲдё»иҰҒжҲҗеҲҶдёә Cu 2 S пјүдёәеҺҹж–ҷеҶ¶зӮјй“ңгҖӮ ж–№жі• 1 пјҡзҒ«жі•зӮјй“ң .Cu 2 S еңЁй«ҳжё©дёӢдёҺж°§ж°”еҸҚеә”зҡ„йғЁеҲҶиҪ¬еҢ–е…ізі»еҰӮеӣҫпјҡ в‘ Cu 2 O дёӯй“ңе…ғзҙ зҡ„еҢ–еҗҲд»·дёә ________ пјӣ в‘ЎеҸҚеә” 2 зҡ„еҹәжң¬зұ»еһӢжҳҜ ________ пјӣ ж–№жі• 2 пјҡз”ҹзү©зӮјй“ңгҖӮ Cu 2 S еңЁй…ёжҖ§зҺҜеўғе’Ңеҫ®з”ҹзү©иҸҢзұ»зҡ„дҪңз”ЁдёӢиҪ¬еҢ–дёә CuSO 4 зҡ„еҺҹзҗҶжҳҜ Cu 2 S+O 2 +2H 2 SO 4 в•җ2CuSO 4 +2H 2 O+X гҖӮ в‘ў X зҡ„еҢ–еӯҰејҸдёә ________ пјӣ в‘Јд»Һеҗ«жңү CuSO 4 е’Ң H 2 SO 4 зҡ„ж··еҗҲжә¶ж¶Ідёӯеӣһ收й“ңпјҢиҜ·иЎҘе……е®Ңж•ҙе®һйӘҢж–№жЎҲгҖӮ жӯҘйӘӨ 1 пјҡеҗ‘дёҖе®ҡйҮҸзҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸзҡ„иҜ•еүӮ Y пјҢиҝҮж»ӨпјҢеҫ—еҲ°ж»ӨжёЈе’Ңж»Өж¶І 1 гҖӮ жӯҘйӘӨ 2 пјҡеҸ–жӯҘйӘӨ 1 дёӯзҡ„ж»ӨжёЈпјҢ ________ пјҢиҝҮж»ӨпјҢеҫ—еҲ° Cu е’Ңж»Өж¶І 2 гҖӮ жӯҘйӘӨ 3 пјҡе°Ҷж»Өж¶І 1 дёҺж»Өж¶І 2 еҗҲ并пјҢеҶ·еҚҙз»“жҷ¶пјҢеҫ—еҲ° FeSO 4 вҖў7H 2 O жҷ¶дҪ“гҖӮ еҶҷеҮәжӯҘйӘӨ 1 дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ ________ пјҲд»»еҶҷ 1 дёӘпјүгҖӮ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°®еҸҠе…¶еҢ–еҗҲзү©зҡ„ вҖң д»·зұ»дәҢз»ҙеӣҫ вҖқ еҰӮеӣҫжүҖзӨәгҖӮ пјҲ 1 пјү A зӮ№еҜ№еә”зҡ„зү©иҙЁеҸҜд»ҘжҳҜ ___ пјҲеЎ«еӯ—жҜҚпјүгҖӮ a пјҺж°®ж°” b пјҺж°§ж°” c пјҺж°ўж°” пјҲ 2 пјү B зӮ№еҜ№еә”зү©иҙЁзҡ„еҢ–еӯҰејҸжҳҜ ___ пјҲеЎ«еӯ—жҜҚпјүгҖӮ a пјҺ N 2 O В В В В В В В b пјҺ NO В В В В В В В В c пјҺ N 2 O 3 пјҲ 3 пјү NH 3 вҖўH 2 O зҡ„зү©иҙЁзұ»еҲ«жҳҜ ___ пјҲеЎ«еӯ—жҜҚпјүгҖӮ a пјҺй…ё b пјҺзўұ c пјҺзӣҗ пјҲ 4 пјү KNO 3 еңЁеӣҫдёӯеҜ№еә”зҡ„зӮ№жҳҜ ___ пјҲеЎ«еӯ—жҜҚпјүгҖӮ a пјҺ C В В В В В В В b пјҺ D В В В В В В В c пјҺ E |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
家用зҮғж–ҷеҸҳиҝҒиҝҮзЁӢзҡ„зӨәж„ҸеӣҫеҰӮеӣҫпјҡ пјҲ 1 пјү 2020 е№ҙпјҢеҸ—ж–°еҶ з–«жғ…зҡ„еҪұе“ҚпјҢе…Ёзҗғе·Ҙдёҡз”ҹдә§жҺ’ж”ҫзҡ„жё©е®Өж°”дҪ“жҜ” 2019 е№ҙ _____ пјҲеЎ« вҖң дёҠеҚҮ вҖқ жҲ– вҖң дёӢйҷҚ вҖқ пјүгҖӮ пјҲ 2 пјү з§ёз§ҶеңЁйҡ”з»қз©әж°”зҡ„жқЎд»¶дёӢеҸ—зғӯеҲҶи§Јз”ҹжҲҗ H 2 гҖҒ CH 4 е’Ң CO зӯүж°”дҪ“пјҢеҲҷз§ёз§ҶдёӯдёҖе®ҡеҗ«жңүзҡ„е…ғзҙ жңү _____ пјӣз…ӨзӮӯзҮғзғ§ж—¶жҺ’ж”ҫеҮә NO 2 гҖҒ _____ зӯүж°”дҪ“пјҢеңЁз©әж°”дёӯдјҡеҪўжҲҗй…ёйӣЁгҖӮ пјҲ 3 пјү з”ұж¶ІеҢ–зҹіжІ№ж°”пјҲдё»иҰҒжҲҗеҲҶдёә C 3 H 8 пјүж”№дёәеҺӢзј©еӨ©з„¶ж°”пјҲдё»иҰҒжҲҗеҲҶдёә CH 4 пјүж—¶пјҢзҮғж°”жҠҘиӯҰеҷЁеә”е®үиЈ…еңЁзҒ¶е…·зҡ„ ____ пјҲеЎ« вҖң дёҠж–№ вҖқ жҲ– вҖң дёӢж–№ вҖқ пјүпјӣеҶҷеҮә CH 4 е®Ңе…ЁзҮғзғ§зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ ____ гҖӮ пјҲ 4 пјү дёәе®һзҺ°жҲ‘еӣҪ вҖң2030 е№ҙеүҚзўіиҫҫеі°пјҢ 2060 е№ҙеүҚзўідёӯе’Ң вҖқ зҡ„зӣ®ж ҮпјҢдҪ и®ӨдёәиғҪжәҗз»јеҗҲеҲ©з”Ёзҡ„и¶ӢеҠҝжҳҜ _____ гҖӮ |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
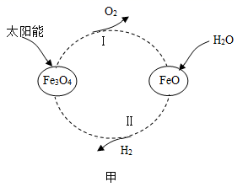
ж°ўж°”жҳҜдёҖз§ҚеҸҜжҢҒз»ӯз ”еҸ‘зҡ„ж–°иғҪжәҗе’Ңе·ҘдёҡеҺҹж–ҷгҖӮ пјҲ 1 пјү еҲ©з”ЁеӨӘйҳіиғҪе°Ҷж°ҙиҪ¬еҢ–дёәж°ўиғҪжҳҜдёҖз§ҚзҗҶжғійҖ”еҫ„гҖӮжҹҗз§Қе…үеҲҶи§Јж°ҙзҡ„иҝҮзЁӢеҰӮеӣҫз”ІжүҖзӨәгҖӮ в‘ иҜҘиҪ¬еҢ–дёӯеҫӘзҺҜеҲ©з”Ёзҡ„зү©иҙЁжңү Fe 3 O 4 е’Ң ______ пјҲеЎ«еҢ–еӯҰејҸпјүпјӣ в‘ЎдёҺз”өи§Јж°ҙзӣёжҜ”пјҢиҜҘж–№жі•зҡ„дјҳзӮ№жҳҜ ______ гҖӮ пјҲ 2 пјү CH 2 п№Ј H 2 O еӮ¬еҢ–йҮҚж•ҙжҳҜзӣ®еүҚеӨ§и§„жЁЎеҲ¶еҸ– H 2 зҡ„йҮҚиҰҒж–№жі•пјҢз”ҹдә§иҝҮзЁӢдёӯж¶үеҸҠзҡ„йҮҚиҰҒеҸҚеә”жңү CH 4 +H 2 O в‘ еҗ‘еӮ¬еҢ–йҮҚж•ҙдҪ“зі»дёӯжҠ•е…ҘдёҖе®ҡйҮҸзҡ„ CaO еҸҜжҸҗй«ҳ H 2 зҡ„зҷҫеҲҶеҗ«йҮҸпјҢеҺҹеӣ жҳҜ ______ пјӣ в‘ЎеҰӮеӣҫд№ҷжүҖзӨәпјҢжҠ•е…Ҙзәізұі CaO ж—¶пјҢ H 2 зҡ„зҷҫеҲҶеҗ«йҮҸжңҖеӨ§зҡ„еҺҹеӣ жҳҜ ______ гҖӮ пјҲ 3 пјү ж°ўж°”еҸҜз”ЁдәҺй’ўй“ҒеҶ¶зӮјгҖҒеҗҲжҲҗж°Ёе’ҢеҗҲжҲҗз”ІйҶҮзӯүе·ҘдёҡгҖӮеҶҷеҮәиөӨй“ҒзҹҝпјҲдё»иҰҒжҲҗеҲҶдёә Fe 2 O 3 пјүдёҺж°ўж°”еңЁй«ҳжё©дёӢзӮјй“Ғзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ ______ гҖӮ |
|
- 2019-2020е№ҙд№қе№ҙзә§дёӢжңҹжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲеұұдёңзңҒйқ’еІӣеёӮеёӮеҚ—еҢәйқ’еІӣ26дёӯпјү
- й•ҝжІҷеёӮд№қе№ҙзә§еҢ–еӯҰ2017е№ҙдёҠжңҹжңҹжң«иҖғиҜ•еҗҢжӯҘз»ғд№
- 2019-2020е№ҙд№қе№ҙзә§дёҠеҶҢ第дёүж¬ЎжңҲиҖғеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲеұұдёңзңҒж»Ёе·һеёӮйғЁеҲҶеӯҰж Ўпјү
- иҫҪе®ҒзңҒи‘«иҠҰеІӣеёӮз»ҘдёӯеҺҝ2020-2021е№ҙеҲқдёүдёҠеҶҢжңҹдёӯеҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е№ҝдёңзңҒжғ е·һеёӮжғ дёңеҺҝ2020-2021е№ҙеҲқдёүдёҠеҶҢжңҹжң«еҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- жұҹиӢҸд№қе№ҙзә§еҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢеӯҰжңҹпјүе®Ңж•ҙиҜ•еҚ·
- 2019еұҠд№қе№ҙзә§еҲқдёӯжҜ•дёҡз”ҹеҚҮеӯҰж–ҮеҢ–иҜҫ第дёҖж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶз»јеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲжІіеҢ—зңҒж»Ұе·һеёӮпјү
- е®үеҫҪзңҒе®үеәҶеёӮ2020-2021е№ҙеҲқдёүдёҠеҶҢжңҹжң«еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ