2018辽宁高一上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学在日常生活中有着广泛的应用。下列说法不正确的是 A.炒菜时加碘食盐最好最后放 B.明矾可用于水的杀菌消毒 C.雾霾天气中可以产生丁达尔现象 D.燃料的脱硫和脱氮都是减少酸雨产生的措施 |
|
| 2. | 详细信息 |
|
下列物质中,不属于合金的是 A.钢铁 B.硬铝 C.黄铜 D.水银 |
|
| 3. | 详细信息 |
|
已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃。要从水与丙酮的混合液里将丙酮分离出来,下列方法中最合理的是 A.过滤 B.蒸发 C.蒸馏 D.分液 |
|
| 4. | 详细信息 |
|
下列实验操作中错误的是 A.用规格为10 mL的量筒量取6.0 mL的液体 B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| 5. | 详细信息 |
|
下列溶液中含Cl- 浓度最大的是 A.10 mL0.1mol/L 的FeCl3溶液 B.20 mL 0.1mol/L 的CaCl2 溶液 C.30mL 0.2 mol/L 的KCl溶液 D.100 mL 0.25 mol/L 的NaCl 溶液 |
|
| 6. | 详细信息 |
|
下列表述不正确的是 A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3 B.硅是制造太阳能电池的常用材料 C.四氧化三铁俗称铁红,可用作油漆、红色涂料 D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
|
| 7. | 详细信息 | |||||||||||||||||||||||||
|
下列关于纯净物、混合物、电解质和非电解质的正确组合是
|
||||||||||||||||||||||||||
| 8. | 详细信息 |
|
化学试剂不变质和实验方法科学是化学实验成功的保障。下列试剂保存方法或实验方法中,不正确的是 A.实验室中金属钠通常保存在煤油里 B.存放少量白磷的试剂瓶中应加水封 C.保存FeCl3溶液时,通常在溶液中加少量的单质铁 D.浓硝酸通常保存在棕色试剂瓶中,置于阴凉处 |
|
| 9. | 详细信息 |
|
《青花瓷》冲所描述的“瓶身描述的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为十2 价),下列有关硅酸铜钡的说法不正确的是 A.可用氧化物形式表示为BaO·CuO·2SiO2 B.易溶解于强酸和强碱 C.性质稳定.不易脱色 D. x=6 |
|
| 10. | 详细信息 |
|
对于下列事实的解释错误的是 A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D.向碘水中滴CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘 |
|
| 11. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A.强碱性溶液中:K+、Na+、CO32-、NO3- B.加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- C.能使紫色石蕊变红的溶液中:Na+、A13+、SO42-、HCO3- D.1.0 mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- |
|
| 12. | 详细信息 |
|
已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是 A.2Fe3+ +SO2+ 2H2O=2Fe2+ +SO42-+4H+ B.I2+SO2+2H2O=H2SO4+2HI C.H2O2+H2SO4=SO2↑+O2 ↑+2H2O D.2Fe3+ +2I-=2Fe2++ I2 |
|
| 13. | 详细信息 |
|
下列有关Na2CO3和NaHCO3性质的出较中,正确的是 A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3 B.热稳定性Na2CO3<NaHCO3 C.常温时水溶性Na2CO3<NaHCO3 D.可以用澄清石灰水鉴别Na2CO3和NaHCO3 |
|
| 14. | 详细信息 | |||||||||||||||
|
下列除杂方法不正确的是
|
||||||||||||||||
| 15. | 详细信息 |
|
下列指定反应的离子方程式正确的是 A.NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O B.向FeC13溶液中通入少量Cl2:Fe2++Cl2=2Cl-+Fe3+ C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4 ↓+H2O D.向碳酸氢钙溶液中加入足量石灰水:Ca2+ +HCO3-+OH-=CaCO3 ↓+H2O |
|
| 16. | 详细信息 |
|
用毛笔蘸取少量30% FeCl3溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶被冲到小烧杯中,下列说法正确的是 A.烧杯中的溶液呈黄色 B.铜片无任何变化 C.铜片上有凹陷的“Cu”字 D.发生了反应:Fe3+ +Cu=Cu2++ Fe2+ |
|
| 17. | 详细信息 |
|
下列实验装置不能达到实验目的的是
|
|
| 18. | 详细信息 |
|
下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是 A.氢氧化钠与二氧化碳反应 B.盐酸和碳酸氢钠溶液 C.铜与硝酸反应 D.氯化铝溶液和氢氧化钠溶液反应 |
|
| 19. | 详细信息 | |||||||||||||||
|
下列实验“操作和现象”与“结论”对应关系正确的是
|
||||||||||||||||
| 20. | 详细信息 |
|
下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是 A.氧化镁中混有氧化铝 B.氯化铝溶液中混有氯化铁 C.氧化铁中混有二氧化硅 D.氯化亚铁溶液中混有氯化铜 |
|
| 21. | 详细信息 |
|
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。.上述实验操作的正确顺序应是 A. ①②⑤⑥⑦③④ B. ③④⑥⑤⑦①② C. ④③⑥⑤⑦①② D. ④③⑤⑥⑦②① |
|
| 22. | 详细信息 |
|
设NA代表阿伏加德罗常数,下列说法正确的是 A.常温下,5.6 g铁与足量的盐酸反应,失去的电子数为0.2NA B.标准状况下11.2 L二氧化硫中含有的原于数为2NA C.标准状况下,22.4L氯气发生反应转移电子数一定为2NA D.0.1mol/LCuCl2溶液中Cl-数目是0.2NA |
|
| 23. | 详细信息 |
|
实验室利用以下反应制取少量氨气:NaNO2 +NH4Cl=NaC1+N2 ↑+2H2O,关于该反应的下列说法正确的是 A.NaNO2发生氧化反应 B.每生成1molN2转移的电子的物质的量为3 mol C.NH4 Cl 中的氯元素被还原 D.N2既是氧化剂,又是还原剂 |
|
| 24. | 详细信息 |
|
将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X 为 A.Cl2 B.Cl2O C.Cl2O3 D.ClO2 |
|
| 25. | 详细信息 |
|
把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是 A.3.2g B.4.8g C.5.4g D.6g |
|
| 26. | 详细信息 |
|
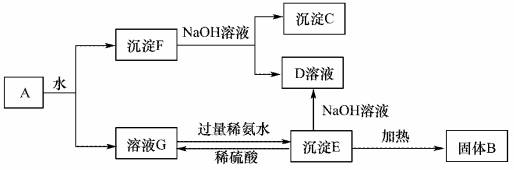
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。 (2)沉淀C与稀硫酸反应的离子方程式为_______________。 (3)溶液G 与过量稀氨水反应的化学方程式为_______________。 |
|
| 27. | 详细信息 |
|
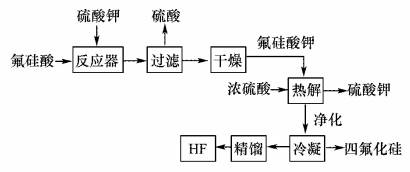
用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。 (1)写出反应器中的化学方程式:________________。 (2)在实验室过滤操作中所用的玻璃仪器有_____________,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________。 (3)该流程中哪些物质可以循环使用:_____________。(用化学式表达) (4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________。 |
|
| 28. | 详细信息 | |||||||||||||||
|
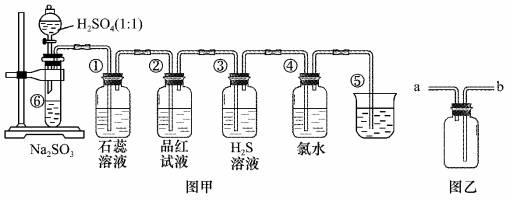
图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。 (2)⑤的作用是________,反应的离子方程式为________ 。 (3)选用图乙收集SO2气体,气体从________ 口 进。 (4)填表格
|
||||||||||||||||
| 29. | 详细信息 |
|
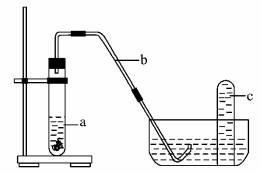
某课外小组准备在实验室配制95 mL1.0 mol/L 的硝酸溶液,然后再研究金属铜与硝酸的反应情况。 (1)配制95 mL 1.0 mol/L 的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。 (2)若用10 mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。 (3)配制过程中,下列操作会引起浓度偏小的是________。 A,.定容摇勾后发现液面低于刻度线,再加水至刻度线 B.定容时俯视容量瓶的刻度线 C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作 D.容量瓶用蒸馏水洗涤后未烘干 E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯 (4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。 ②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。 ③导致红棕色气体在试管c中颜色消失的反应方程式为_________。 |
|
| 30. | 详细信息 |
|
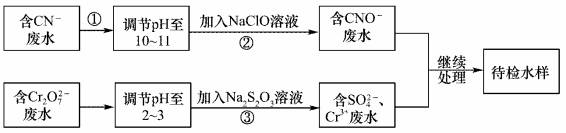
某废水中含有CN-和Cr2O72- 等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:
回答下列问题: (1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为____________。 (2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。 (3)含Cr 3+废水可以加入熟石灰进一步处理,目的是___________________。 |
|