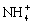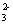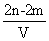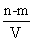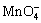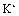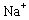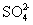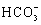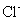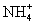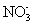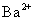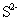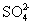福建省2021-2022学年高一上学期期中考试化学试题含解析
| 1. | 详细信息 |
|
A . 食物腐败变质 B . 酒香不怕巷子深 C . 铝表面形成致密的薄膜 D . 食醋洗掉水垢 |
|
| 2. | 详细信息 |
|
A . Al 2 O 3 、 Fe 3 O 4 、 CuO 均为碱性氧化物 B . 氯水、氨水、漂白粉均为混合物 C . 稀豆浆、硅酸、氯化铁溶液均为胶体 D . 烧碱、冰醋酸、蔗糖均为电解质 |
|
| 3. | 详细信息 |
|
A . NaCl 、 BaSO 4 B . 铜、二氧化硫 C . KNO 3 、硫酸溶液 D . KOH 、 CCl 4 |
|
| 4. | 详细信息 |
|
A . 1 mol NH C . 一个水分子的质量约等于 |
|
| 5. | 详细信息 |
|
A . Na 和 O 2 B . NaOH 和 CO 2 C . Na 2 O 2 和 CO 2 D . NaHCO 3 和 Ca(OH) 2 |
|
| 6. | 详细信息 |
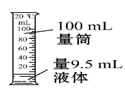
|
A . 点燃酒精灯 C . 称量 10.05g 固体 |
|
| 7. | 详细信息 |
|
A . 全部 B . ②④⑤ C . ②⑤ D . ④ |
|
| 8. | 详细信息 |
|
① 给烧瓶加热必须使用石棉网 ② 制取蒸馏水的装置,若缺少温度计,该实验无法进行 ③ 分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗颈上的小孔 ④ 容量瓶需要干燥后方能使用 ⑤ 实验室制取氯气时,为了防止环境污染,多余的氯气用澄清石灰水吸收 A . ①②③ B . ②④⑤ C . ②③⑤ D . ③④⑤ |
|
| 9. | 详细信息 |
|
A . 氢氧化铜与硫酸反应: OH - + H + =H 2 O B . Cl 2 与水反应: Cl 2 + H 2 O =2H + + Cl - + ClO - C . 向稀盐酸溶液中加入铁粉: 2Fe + 6H + =2Fe 3 + + 3H 2 ↑ D . 铜片插入硝酸银溶液中: Cu + 2Ag + =Cu 2 + + 2Ag |
|
| 10. | 详细信息 |
|
A . 标准状况下, 22.4LCCl 4 的分子数为 N A B . 1mol C . 常温常压下, 48gO 2 和 O 3 的混合气体所含原子数为 3 N A D . 物质的量浓度为 0.5 mol·L -1 的 MgCl 2 溶液,含有的 Cl - 数为 N A |
|
| 11. | 详细信息 |
|
A . 3 : 2 B . 3 : 4 C . 3 : 5 D . 1 : 2 |
|
| 12. | 详细信息 |
|
A . Br 2 > Fe 3 + > I 2 B . Fe 3 + > Br 2 > I 2 C . Br 2 > I 2 > Fe 3 + D . Fe 2 + > Cu 2 + > Fe 3 + |
|
| 13. | 详细信息 |
|
A . 酸性氧化物与金属氧化物发生氧化还原反应 B . 没有水生成,也没有沉淀和气体生成的复分解反应 C . 有单质参加的非氧化还原反应 D . 没有电子转移的氧化还原反应 |
|
| 14. | 详细信息 |
|
A .热稳定性: Na 2 CO 3 < NaHCO 3 B .常温时水溶液中的溶解度: Na 2 CO 3 < NaHCO 3 C .与稀盐酸反应快慢: Na 2 CO 3 < NaHCO 3 D .物质的量相同时,消耗盐酸: Na 2 CO 3 < NaHCO 3 |
|
| 15. | 详细信息 |
|
A . NaClO 3 是还原剂 B . Na 2 SO 3 被还原 C . H 2 SO 4 发生氧化反应 D . 生成 1 mol ClO 2 ,转移电子数为 N A |
|
| 16. | 详细信息 | ||
|
编号 | 实验目的 | 操 作 | |
| A | 取出分液漏斗中的上层有机液体 | 先将下层液体从分液漏斗下端管口放出,关闭活塞,换一只烧杯,再将上层有机液体从下端管口放出 | |
| B | 配制200 mL 1 mol·L -1 NaOH溶液 | 准确称取8.0 g NaOH固体,放入200 mL容量瓶中,加水至刻度线,振荡摇匀 | |
| C | 检验某工业纯碱中是否含有NaCl | 取少量样品于试管中,加水溶解,再加入足量稀硝酸,最后滴加AgNO 3 溶液,有白色沉淀生成 | |
| D | 检验某溶液中是否含有SO 4 2- | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失 | |
| 17. | 详细信息 |
|
A . 除去铁粉中的铜粉,加入足量稀硫酸反应后进行过滤 B . 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有 CO C . 制备 Fe(OH) 3 胶体时,通常是将 Fe(OH) 3 固体溶于沸水中 D . 不用任何其他试剂就可以鉴别 NaOH 溶液和 FeCl 3 溶液 |
|
| 18. | 详细信息 |
|
A . + 3 B . + 5 C . + 6 D . + 7 |
|
| 19. | 详细信息 |
|
A . |
|
| 20. | 详细信息 |
|
A . C . |
|
| 21. | 详细信息 |
|
A . 9 : 16 B . 9 : 32 C . 3 : 4 D . 9 : 8 |
|
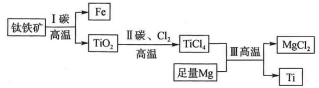
| 22. | 详细信息 |
|
A . 步骤 Ⅰ、 II 中均发生氧化还原反应 B . 步骤 Ⅰ、Ⅱ中碳元素的化合价均升高 C . 步骤 Ⅲ中反应可在氩气环境中进行,也可在空气中进行 D . 可用稀硫酸除去金属钛中的少量镁杂质 |
|
| 23. | 详细信息 |
|
( 1 ) 现有下列基本粒子: 1 H 、 2 H 、 3 H 、 40 K 、 40 Ca , 它们分属 ___________ 种元素,互为同位素的原子为 ___________ 。 ( 2 ) 明矾 [KAl(SO 4 ) 2 ·12H 2 O] 溶于水后发生电离的方程式是 ___________ ,明矾的用途是 ___________ 。 ( 3 ) 可用于分离或提纯物质的方法有: A .过滤 B .萃取 C .渗析 D .蒸馏 E .分液 F .灼热氧化。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内: ①除去淀粉溶液中的少量碘化钠 ___________ ; ②提取溴水中的溴单质 ___________ ; ③除去 CuO 中的 Cu ___________ ; ④除去水中的 Na + 、 |
|
| 24. | 详细信息 |
|
( 1 ) 反应 ①中 ___________ ( 填元素符号,下同 ) 元素被氧化,还原产物为 ___________ ;反应 ②中 ___________ 作还原剂, ___________ 元素被还原。 ( 2 ) 当反应 ①生成 2 g H 2 时,消耗 H 2 SO 4 的质量是 ___________ g . ( 3 ) 反应 ②中生成 32 g SO 2 气体时,其中有 ___________ g H 2 SO 4 被还原,转移电子 ___________ mol 。 II .实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为 33.6L 。请回答下列问题: ( 4 ) 反应中被氧化的 HCl 的物质的量是 ___________ 。 ( 5 ) 若已知盐酸浓度小于 10 mol·L -1 时则不易被 MnO 2 氧化,现用浓度为 12 mol·L -1 的浓盐酸与 8.7g MnO 2 反应,要使 MnO 2 全部反应掉生成最多氯气,则至少加入这种盐酸 ___________ 毫升。 |
|
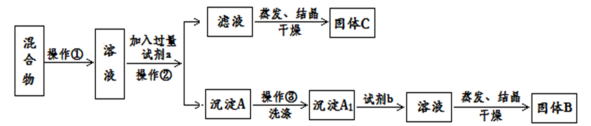
| 25. | 详细信息 |
|
试回答下列问题: (1) 操作 ① 需用到的玻璃仪器有有 ___________ 。 (2) 试剂 a 是 ___________ ( 填化学式,下同 ) ,试剂 b 是 ___________ 。 (3) 加入试剂 b 所发生反应的化学方程式为 ___________ 。 (4) 该方案能否达到实验目的?答: ___________ ( 填 “ 能 ” 或 “ 不能 ) 。若不能,应如何改进?答: _ ( 若能,此问不用回答 ) 。 |
|
| 26. | 详细信息 |
|
净含量: 500mL 密度: 1.19g·cm -3 主要成分: 25%NaClO(NaClO 的摩尔质量 74.5g·mol -1 ) 注意事项:密封保存 ( 1 ) 计算该 “84” 消毒液的物质的量浓度 ___________ mol·L -1 ( 保留小数点后一位 ) 。 ( 2 ) 某实验需用 480mL2.0mol·L -1 NaClO 的消毒液,现用 NaClO 固体配制。需要用托盘天平称量 NaClO 的固体质量为 ___________ g ; ( 3 ) 在配制过程中,除需要烧杯、托盘天平、玻璃棒、药匙外还必需的仪器有 ___________ 、 ___________ ( 写仪器名称 ) 。 ( 4 ) 定容时的操作为:缓缓地将蒸馏水注入容量瓶中,直到容量瓶中的液面距离容量瓶的 ___________ ,改用 ___________ 。定容时超出刻度线应 ___________ 。 ( 填操作名称 ) ( 5 ) 下列操作可能使配制溶液浓度偏低的是 ( 填字母 ) ___________ 。 A .移液时,未洗涤烧杯内壁和玻璃棒 B .溶解后未经冷却就移液 C .移液时,有少量液体溅出 D .定容时,俯视刻度线 E .容量瓶用蒸馏水洗净后,没烘干就直接使用 |
|
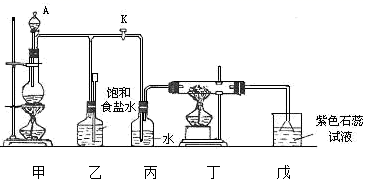
| 27. | 详细信息 |
|
(1) 仪器 A 的名称为 __________ 。 (2) 甲是氯气发生装置,其中反应的化学方程式为 _________________ 。 (3) 实验开始时,先点燃甲处的酒精灯,打开旋塞 K ,让 Cl 2 充满整个装置,再点燃丁处酒精灯,连接上戊装置。 Cl 2 通过丙瓶后再进入丁。丁装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为 CO 2 和 HCl 。试写出丁中反应的化学方程式: _______________ 。装置丙的主要作用是 ______________ 。 (4) 若将戊处烧杯中溶液改为澄清石灰水,反应过程现象为 _____ ( 选填标号 ) 。 A .无明显变化 B .有白色沉淀生成 C .先生成白色沉淀,而后白色沉淀消失 (5) 丁处反应完毕后,关闭旋塞 K ,移去酒精灯。但由于余热的作用,甲处仍有 Cl 2 产生,此时乙中的现象是 _________ ,此时,乙的作用是 ___________ 。 |
|