2019届高三9月月考化学在线测验完整版(四川省成都市龙泉第二中学)
| 1. | 详细信息 |
|
化学与人类的生活息息相关,下列有关说法正确的是( ) A. 因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用 B. 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 C. 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
|
| 2. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法正确的是( ) A. 标准状况下,11.2L甲醇中含有的分子数为0.5NA B. 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA C. 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA D. 25°C时,1.0L , PH = 13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
|
| 3. | 详细信息 | ||||||||||||||||||||
下列实验操作和现象所得结论正确的是
|
|||||||||||||||||||||
| 4. | 详细信息 |
|
W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构, W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( ) A. 离子半径:W> Z > X B. 单质熔点:W>Z C. 最高正价:W> X >Y >Z D. W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
|
| 5. | 详细信息 |
由前18号元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( ) A. 若D为白色沉淀,与A摩尔质量相等,则X一定是含铝元素的盐 B. 若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原Fe2O3 C. 若D为CO,C能和E反应,则A一定为Na2O2,其阳离子与阴离子比为2:1 D. 若X是Na2CO3,C为CO2分子,则A一定是氯气,且D和E不反应 |
|
| 6. | 详细信息 |
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下图。关于利尿酸的说法中正确的是( )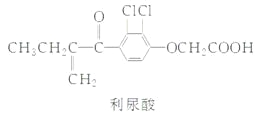 A.它是分子式是C13H31O4Cl2 B.它不能使酸性高锰酸钾溶液褪色 C.它不能与饱和碳酸钠溶液反应放出CO2 D.它能发生取代反应、加成反应和酯化反应 |
|
| 7. | 详细信息 | ||||||||
部分弱酸的电力平衡常数如下表所示:
|
|||||||||
| 8. | 详细信息 |
醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下: Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g); 2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq) 2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s) 请回答下列问题: (1)仪器1的名称是______________________________________。 (2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。 A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液,一段时间后再加盐酸 C.先加盐酸,一段时间后再加三氯化铬溶液 (3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。 (4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。 (5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。 (6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31, |
|
| 9. | 详细信息 | ||||||||||||||||||||||||||||||||
|
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。 【相关资料】 ①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。 ②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。 ③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。 【实验过程】 在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验: (1)请完成以下实验设计表(表中不要留空格)。
|
|||||||||||||||||||||||||||||||||
| 10. | 详细信息 |
二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下: (1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。 (2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。 (3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。 (4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字) |
|
| 11. | 详细信息 |
|
【化学选修-物质结构与性质】 已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题: (1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号) (2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。 (3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。 (4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______, 在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)  |
|
| 12. | 详细信息 |
6-硝基胡椒基酸K是合成心血管类药物米络沙星的中间体,在实验室中合成路线如下图所示(部分反应条件已经略去):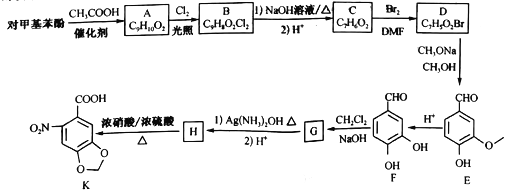 已知:连在同一个碳上的两个羟基易脱水形成羰基。 回答下列问题: (1)C的名称为_______,H 中官能团的名称为__________。 (2)由C生成D的反应类型为_______,G 的结构简式为_______ 。 (3)由A生成B的化学方程式为_______ 。 (4)R是E的同分异构体,R中有两个取代基,其中一个为羟基且与苯环直接相连,另一个取代基含有“ (5)写出以邻苯二酚 |
|




