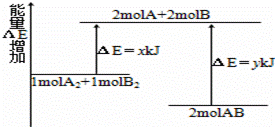2020陕西高二上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列说法不正确的是( )
|
|
| 2. | 详细信息 |
|
下列变化中,属于吸热反应的是( ) ④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰 ⑥CaCO3高温分解 ⑦CO2+C高温 2CO ⑧Ba(OH)2•8H2O与固体NH4Cl混合 ⑨C+H2O(g)高温CO+H2 ⑩Al与HCl反应.
|
|
| 3. | 详细信息 |
|
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
|
|
| 4. | 详细信息 |
|
1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是() A.H2(g)+1/2 O2 (g)═H2O(l) △H=-285.8kJ·mol-1
|
|
| 5. | 详细信息 |
|
在测定中和热的实验中,下列说法正确的是( )
|
|
| 6. | 详细信息 |
|
热化学方程式中化学式的右边要注明物质状态,主要因为( ) A.说明反应条件 B.可以具体说明反应进行的情况 C.物质呈现的状态与生成什么物质有关 D.物质呈现的状态与反应热有关
|
|
| 7. | 详细信息 |
|
合理利用燃料减小污染符合“绿色”理念,下列关于燃料的说法正确的是( )
|
|
| 8. | 详细信息 |
|
已知:Fe2O3(s)+3/2 C(s)=3/2 CO2(g)+2Fe(s)△H=234.1kJ·mol−1 C(s)+O2(g)=CO2(g)△H=−393.5 kJ·mol−1 则2Fe(s)+3/2 O2(g )=Fe2O3(s) 的△H是( )
|
|
| 9. | 详细信息 |
|
已知: CO2(g)+C(s)=2CO(g) △H1 C(s)+H2O(g)=CO(g)+H2(g) △H2 CO(g)+H2O(g)=CO2(g)+H2(g) △H3 CuO(s)+CO(g)=Cu(s)+CO2(g) △H4 2CuO(s)+C(s)=2Cu(s)+CO2(g) △H5 下列关于上述反应焓变的判断不正确的是( ) A. △H1>0 B. △H2>0 C. △H2<△H3 D. △H5=2△H4+△H1
|
|
| 10. | 详细信息 |
|
下列说法不正确的是( ) A.利用盖斯定律可计算某些难以直接测量的反应焓变 B.在指定状态下各物质的焓值都是确定且是唯一的 C.如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓 D.变当同一个化学反应以不同的过程完成时,反应的焓变是不同的 可由相关化学方程式的焓变相加减而得到
|
|
| 11. | 详细信息 |
|
下列关于化学反应速率的说法,不正确的是( )
|
|
| 12. | 详细信息 |
|
用大理石(杂质不与稀盐酸反应)与稀盐酸反应制CO2,实验过程记录如图所示,下列说法正确的是( )
A.OE段表示的反应速率最快 B.EF段表示的反应速率最快,收集CO2最多 C.FG段收集的CO2最多 D.OG段表示随着时间的推移,反应速率逐渐增大
|
|
| 13. | 详细信息 |
|
10mL1mol•L-1盐酸与一块大理石的反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
|
|
| 14. | 详细信息 | ||||
|
反应4NH3(g)+ 5O2(g)= 4NO(g)+ 6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为( )
|
|||||
| 15. | 详细信息 |
|
如图为反应N2+3H2
|
|
| 16. | 详细信息 |
|
在一定温度下,可逆反应A(g)+3B(g) A.单位时间内生成nmolA的同时生成3nmol的B
|
|
| 17. | 详细信息 |
|
下列说法中正确的是( ) A. 在原电池中,物质在负极发生氧化反应 B. 在原电池中,电子由正极流向负极 C. 在电解池中,物质在阴极发生氧化反应 D. 在电解池中,与电源正极相连的电极是阴极
|
|
| 18. | 详细信息 |
|
若要在铜片上镀银时,下列叙述中错误的是( )
|
|
| 19. | 详细信息 |
|
一定温度下,反应 N2(g+3H2(g) A.2△H 和 2K B.-2△H 和 K2 C.2△H 和 -2K D.-2△H 和 K-2
|
|
| 20. | 详细信息 |
|
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g)
|
|
| 21. | 详细信息 |
|
每空1分共6分) A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol.L-1。反应进行2min后A的浓度为0.8mol.L-1,B的浓度为0.6mol.L-1,C的浓度为0.6mol.L-1。 (1)2min内反应的平均速率为:v(A)= , v(B)= , v(C)= 。 (2)三者数值之间的关系是:v(A)= v(B)= v(C)。 (3)该反应的化学方程式为: 。
|
|
| 22. | 详细信息 |
|
每空2分共10分) 写出下列反应的热化学方程式:
(2)1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量.
(3)2molC2H2(g)在O2(g)中完全燃烧生成CO2和H2O(l),放出2598.8KJ热量.
(4)1molC(石墨)与适量的H2O(g)反应生成CO(g)和H2(g),吸收131.3KJ热量
(5)2g H2和足量的O2充分燃烧生成液态水,放出热量为285.8KJ,则H2和O2燃烧的热化学方程式:
|
|
| 23. | 详细信息 |
|
(每空2分共6分) 如图所示,若电解5min时,测得铜电极的质量增加2.16g,试回答:
|
|
| 24. | 详细信息 |
|
每空2分共10分) 取6根铁钉,6支干净的试管及其他材料,如图所示。
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触; 试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触; 试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触; 试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触; 试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片; 试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。 把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。 (1)上述实验中铁钉发生了电化学腐蚀的是 (填试管序号);在电化学腐蚀中,负极反应是 ,正极反应是 . (2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是 . (3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法).
|
|
| 25. | 详细信息 |
|
完成下列问题(共4分) (1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:______ C(s)+1/2O2(g)=CO(g)△H1=-110.5kJ•mol-1, 则C(s)+CO2(g)=2CO(g) 的△H为______. H2(g)+1/2O2(g)═H2O(l)△H= - 285kJ/mol C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H= - 2220.0kJ/mol 已知:H2O(l)═H2O(g)△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: .
|
|
| 26. | 详细信息 | ||||||||||||
|
共4分) 为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)
(1)在500s内用H2表示的化学反应速率是 . (2)在1000s内用CO表示的化学反应速率是 , 1000s时CO的转化率是 ___. (3)在500s时生成的甲醇的浓度是 ___.
|
|||||||||||||