2019云南高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列叙述正确的是 A.油脂和蛋白质都属于高分子化合物 B.天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 C.蚕丝、羊毛、棉花可用来制作纺织品,它们的成分都是蛋白质 D.葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
|
|
| 2. | 详细信息 |
|
下列叙述正确的是(NA代表阿伏加德罗常数的值) A.将22.4 L HCl配成1 L溶液,c(H+)为1 mol/L B.2 L 2 mol/L的盐酸,c(H+)为2 mol/L C.从100 mL 2 mol/L的盐酸取出10 mL,c(H+)为0.2 mol/L D.1 mol/L 的盐酸中所含Cl-数目为NA
|
|
| 3. | 详细信息 |
|
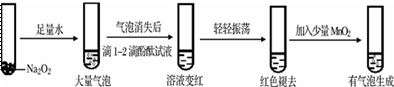
在溶液中加入Na2O2后仍能大量共存的离子组是 A. NH4+、Ba2+、Cl-、NO3- B. K+、AlO2-、Cl-、SO42- C. Ba2+、Mg2+、NO3-、HCO3- D. Na+、Cl-、CO32-、SO32-
|
|
| 4. | 详细信息 |
|
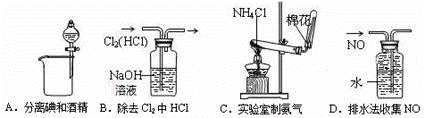
下列装置所示的实验中,能达到实验目的的是
|
|
| 5. | 详细信息 |
|
中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应:TiCl4+2Mg==Ti+2MgCl2,下列有关该反应的说法正确的是 A.TiCl4是还原剂 B.Mg得到电子 C.TiCl4发生氧化反应 D.Mg被氧化
|
|
| 6. | 详细信息 |
|
下列离子方程式书写正确的是 A. 氯化铁溶液溶解铜片:Fe3++ Cu=Fe2++ Cu2+ B. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ C. AlCl3溶液中加入足量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O D. 金属钠与水反应:2Na+2H2O=2Na++2OH- +H2↑
|
|
| 7. | 详细信息 |
|
下列说法中正确的是( ) A.钠的含氧化合物都是碱性氧化物 B.金属钠久置空气中最终转变为Na2O2 C.钠可以将钛、铌等金属从其熔融的氯化物中置换出来 D.过氧化钠只具有氧化性不具有还原性
|
|
| 8. | 详细信息 |
|
短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y3+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列相关说法错误的是 A.简单氢化物的稳定性:W<X B.单核阴离子还原性:Z>X C.电解Y的熔融氯化物可制备Y单质 D.WZ2分子中只存在共价键
|
|
| 9. | 详细信息 |
|
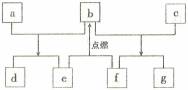
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是 A. 简单离子的半径:Y>Z>X B. 简单氢化物的沸点:Y>X C. 最高价氧化物对应水化物的碱性:Z>Y D. W、Y的氧化物所含化学键类型相同
|
|
| 10. | 详细信息 |
|
向BaCl2溶液中通入SO2气体,溶液仍然澄清;若将BaCl2溶液分盛在两支试管中,一只试管加稀HNO3,另一只加NaOH溶液,然后再通入SO2气体,结果两支试管都有白色沉淀产生。由此得出的下列结论中不合理的是 A.SO2是酸性氧化物、SO2具有还原性 B.两支试管中的白色沉淀不是同种物质 C.BaCl2既能跟强酸、又能跟强碱反应,具有两性 D.升高pH时,SO2水溶液中SO32-浓度增大
|
|
| 11. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A. 2.4gMg在空气中完全燃烧,转移电子数一定为0.2NA B. 标准状况下,2.24L HF中所含原子总数一定为0.2NA C. 5.6gFe在稀硝酸中完全溶解,转移电子数一定为0.2NA D. 12.0g熔融的NaHSO4中,阳离子的总数一定为0.2NA
|
|
| 12. | 详细信息 |
|
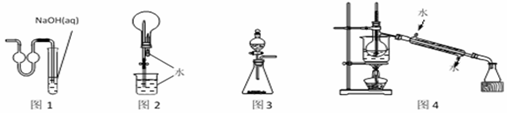
用下列实验装置进行相应实验,能达到实验目的的是
A. 用图1装置作为制取少量二氧化硫的尾气吸收装置 B. 用图2装置进行二氧化碳喷泉实验 C. 用图3装置进行二氧化锰和浓盐酸制取氯气的实验 D. 用图4装置进行石油的分馏实验
|
|
| 13. | 详细信息 |
|
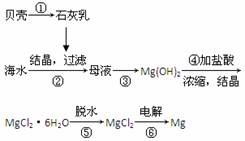
从海水中提取镁的工艺流程可表示如下:
A.用此法提取镁的优点之一是原料来源丰富 B.步骤⑥电解熔融MgCl2时可制得Mg(OH)2 C.步骤⑤可将晶体置于HCl气体氛围中脱水 D.上述工艺流程中涉及化合、分解和复分解反应
|
|
| 14. | 详细信息 |
|
下列说法正确的是 A. 用干燥的pH试纸测定氯水的pH B. 向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- C. 向某溶液中加入浓氧氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ D. 向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3-
|
|
| 15. | 详细信息 |
|
下列说法中正确的是 A. 干冰、盐酸都是电解质 B. Na2O2、Fe2O3、CaO既属于碱性氧化物,又属于离子化合物 C. 有单质参加或有单质生成的反应不一定属于氧化还原反应 D. 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
|
|
| 16. | 详细信息 |
|
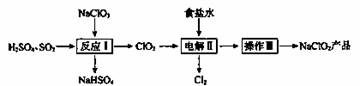
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2 请回答下列问题: (1)NaClO2中Cl的化合价为____________。 (2)反应I: ① ②写出反应I的化学方程式: _____________________________________________。 (3)电解II: ①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的Mg2+和Ca2+,需要加入的试剂分别为_______、___________。 ②电解过程中被氧化的物质是________。 ③可用NaOH溶液吸收电解产生的Cl2,该反应的离子方程式是______________。 (4)操作III: 滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
|
|
| 17. | 详细信息 |
|
实验室可用下列几组试剂制取少量NH3: ①固体Ca(OH)2和NH4Cl;②浓氨水和固体CaO;③浓氨水。 请回答下列问题: (1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第①组试剂中产生NH3的化学方程式可表示为____________________________________。 (2)下面的制取装置图中,方法①应选用装置________(填“A”或“B”,下同),方法②应选用装置________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________(填字母)。 A.浓硫酸B.固体氢氧化钠C.五氧化二磷 D.碱石灰E.固体CaO F.无水CaCl2 (4)检验集气瓶中是否收集满氨气的方法是__________________________________。 (5)为防止环境污染,如下装置(盛放的液体为水)可用于吸收多余NH3的是________(填序号)。
|
|
| 18. | 详细信息 |
|
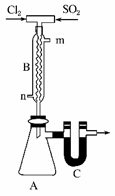
查阅资料:SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,极易水解,遇潮湿空气会产生白雾。 (1)化合物SO2Cl2中S元素的化合价是__________。 (2)实验室中制备氯气时为得到干燥纯净的氯气,应将气体依次通过盛有_______和_______的洗气瓶。 (3)用如图所示装置制备SO2Cl2。 ①B中冷凝水从__________ (填“m”或“n”)口进入。 ②C中的药品是______。目的一是:_______________,目的二是:_______________。 ③向A所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,写出SO2Cl2与H2O反应的化学方程式:_______________。
|
|
| 19. | 详细信息 |
|
(1)将金属钠置于空气中的加热,可以观察到有淡黄色固体生成,试写出该物质的电子式:_____________ ;如金属钠中混有少量金属钾,如何鉴别钾元素的存在?试简述实验操作及对应现象 ; (2)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:_________________________________________。 (3)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置可以是_____________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:
①用化学方程式解释使酚酞试液变红的原因___________________,依据实验现象推测红色褪去的原因是________________。 ②加入MnO2反应的化学方程式为_______________________。
|
|
| 20. | 详细信息 |
|
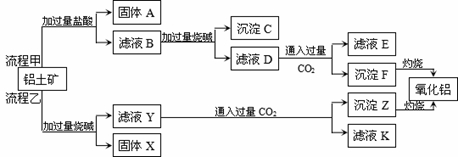
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3的两种工艺流程如下:
请回答下列问题: (1)流程甲加入盐酸后生成Fe3+的离子方程式为 ; (2)铝土矿中固体A 是 (填化学式),写出沉淀F转化为氧化铝的化学方程式 ; (3)流程乙中,写出滤液Y 与过量CO2反应生成沉淀Z的离子方程式为 ; (4)固体X 是 (填化学式) (5)利用铝热反应原理,写出有Cr2O3制备Cr的化学方程式_________________________________。
|
|