2018四川高一下学期人教版高中化学开学考试
| 1. | 详细信息 |
|
化学与生产、生活密切相关。下列说法正确的是 A.大量使用薪柴为燃料,践行低碳生活 B.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 C.针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质。 D.CO2或SO2的排放是形成酸雨的主要原因 |
|
| 2. | 详细信息 |
|
无论在化学实验室还是在家中进行实验探究活动,都必须注意安全。下列实验操作正确的是 A.不慎将酒精撒在桌面上引起着火,立即用水浇灭 B.用试管加热固体时,试管口要略向下倾斜 C.将实验用剩的白磷先用二硫化碳溶解,然后倒入垃圾箱 D.稀释浓硫酸时,先在量筒中加入一定体积的水,再在搅拌下慢慢注入浓硫酸 |
|
| 3. | 详细信息 |
|
下列物质属于纯净物的是 A.稀盐酸 B.液氯 C.空气 D.氨水 |
|
| 4. | 详细信息 |
|
在下列化合物中,只有在水溶液状态下才能导电的电解质是 A. NaOH B.酒精 C. KCl. D.H2SO4 |
|
| 5. | 详细信息 |
|
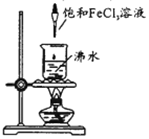
A.用激光笔照射,会出现丁达尔效应 B.将液体静置片刻,会出现沉淀现象 C.所得胶体中分散质的粒子直径大于100nm D.可用滤纸分离提纯得到氢氧化铁胶体 |
|
| 6. | 详细信息 |
|
下列说法正确的是 A.陶瓷的主要成分是碳酸钙 B.硅是制造半导体的常用材料 C.在酒精灯上加热铝箔,铝箔熔化滴落 D.用铁槽车存放浓盐酸 |
|
| 7. | 详细信息 |
|
下列说法中不正确的是 A.自然界中不存在游离态的硫 B.二氧化硫能使酸性高锰酸钾溶液褪色,表现了SO2的还原性 C.二氧化硫能使品红褪色,体现了SO2的漂白性 D.祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2 |
|
| 8. | 详细信息 |
|
下列各溶液中,Na+ 浓度最大的是 A.4L 0.5 mol/L NaCl 溶液 B.1mL 0.3 mol/L Na2SO4 溶液 C.0.8L 0.4 mol/L NaOH 溶液 D.3L 0.15 mol/L Na3PO4 溶液 |
|
| 9. | 详细信息 |
|
下列各组离子在无色溶液中可以大量共存的是 A.H+、SO32-、CO32-、SO42- B.Cu2+、Cl-、NO3-、CO32- C.Mg2+、H+、SO42- 、Cl- D.Mg2+、OH-、CO32-、H+ |
|
| 10. | 详细信息 |
|
某物质灼烧时,焰色反应为黄色,下列判断正确的是 A.该物质一定是钠的化合物 B.该物质一定含钠元素 C.该物质一定是金属钠 D.可确定该物质中不含钾元素 |
|
| 11. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是 A.1mol硫在足量的氧气中充分燃烧,转移电子数为6NA B.标准状况下,22 g CO2与11.2 L H2O含有相同的原子数 C.1molFe在足量的氯气中燃烧,转移电子数为3NA D.标准状况下,1mol Na2O2与足量水充分反应转移的电子数为2NA |
|
| 12. | 详细信息 | ||||||||||||
|
欲进行下列实验,其方案设计合理的是
|
|||||||||||||
| 13. | 详细信息 |
|
水热法制备Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O。下列说法正确的是 A. x=4 B.O2、S2O32-都是氧化剂 C.每转移2mol电子,有1.5molFe2+被氧化 D.氧化产物只有S4O62- |
|
| 14. | 详细信息 |
|
要证明某溶液中不含有Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为 ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液 A.①③ B.③② C.③① D.①②③ |
|
| 15. | 详细信息 |
|
能正确表示下列反应的离子反应方程式为 A. 用小苏打(NaHCO3)治疗胃酸(HC1)过多:CO32-+2H+ =CO2↑+H2O B.氯化铁溶液腐蚀铜箔制印刷线路板:2Fe3++Cu=2Fe2++ Cu2+ C.向明矾溶液中滴加过量Ba(OH)2溶液: 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
|
| 16. | 详细信息 |
|
某无色溶液含有下列离子中的若干种:H+、 NH4+、 Fe3+、Ba2+、Al3+、Cl-、OH-、CO32-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有 A.3种 B.4种 C.5种 D.6种 |
|
| 17. | 详细信息 | |||
|
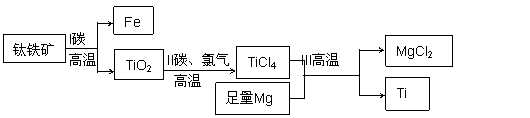
2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2) 提取金属钛的主要工艺流程如图,下列说法错误的是 A.步骤I中碳作还原剂 B.步骤II中未发生氧化还原反应 C.步骤III需在氩气环境中进行,防止金属Mg被空气氧化 D.可用稀硫酸除去金属钛中的少量镁 |
||||
| 18. | 详细信息 |
|
已知还原性由强到弱的顺序为SO3 2->I->Br -, 向NaBr、NaI、Na2SO3 的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是 C.NaCl、Na2 S O4、I2 D. NaCl、Na2 S O4 、 N aI |
|
| 19. | 详细信息 |
|
某种混合气可能含有N2、HCl和CO。把混合气体依次通过足量的NaHCO3溶液、灼热的CuO,气体体积都没有变化,再通过足量的Na2O2固体,气体体积减少,最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体,下列对混合气体组分的判断,正确的是 A. 一定有N2、CO和HCl B. 一定有N2,CO和HCl中至少有一种 C. 一定有N2和HCl D. 一定有N2和CO |
|
| 20. | 详细信息 |
|
向29.6 g Fe2O3、FeO和Cu的混合物中加入1 mol·L-1硫酸400 mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用足量的CO在高温下还原相同质量的原混合物,得到的固体质量为( ) A.16.8 g B.21.6 g C. 23.2 g D.26.4 g |
|
| 21. | 详细信息 |
|
(1)0.5 mol H2O的质量为 ,含有 个氧原子。 (2)质量都是50 g的 HCl、CH4、N2三种气体中,原子数目最多的是气体是 ,在相同温度和相同压强条件下,密度最大的气体是 。 (3)标准状况下11.2L,由CO和H2组成的混合气体的质量为10g,则混合气体的平均摩尔质量为_______,二者体积比为 ; (4)实验室需用浓硫酸配制100 mL 1 mol•L-1的稀硫酸。可供选用的仪器有: ①量筒;②烧杯;③胶头滴管,还必须需要的玻璃仪器有________________ (写仪器名称)。 (5)一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+H2O==RO42-+2Cl-+2H+ ,从而可知在RO3n-中,元素R的化合价是 ,当有标准状况下8.96L Cl2被消耗时,反应中共转移电子物质的量为 mol 。 |
|
| 22. | 详细信息 |
|
化学反应的条件多种多样,“撞击”也是其中的一种.如:NaN3、Fe2O3、KClO4、NaHCO3等组成的混合物受撞击时会产生大量气体,因而曾用作汽车安全气囊的产气药剂,其原理如下: ①NaN3受撞击分解产生金属钠和氮气; ②金属钠将Fe2O3中铁置换出来,同时又将KClO4还原为KCl; ③NaHCO3受热分解. 请回答下列问题: (1)KClO4(高氯酸钾)中氯元素的化合价为 ,NaN3(叠氮酸钠)中阴离子的符号为 。 (2)若取100g上述产气药剂进行实验(假设各物质均反应完全) ①产生的气体成分有 (填化学式)。 ②所得固体产物遇水显强碱性,则固体产物中有 (填化学式)。 ③若气体通过足量的碱石灰后体积为33.6L(标准状况),则产气药剂中NaN3的质量分数为 。 (3)写出过程②金属钠将Fe2O3中铁置换出来,同时又将KClO4还原为KCl中相关的化学方程式: , 。 |
|
| 23. | 详细信息 | ||||
|
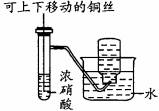
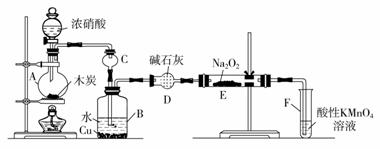
一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。 已知:①室温下,2NO+Na2O2===2NaNO2; ②酸性条件下,NO或NO 如5NO Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
(1)A中观察到的现象是_________________________________。 (2)B中反应的离子方程式是____________________,_______________________。 (3)装置C的作用是___________________,装置F的作用是__________________。 (4)若无装置D,则E中产物除亚硝酸钠外,还有副产物 (填化学式)。 Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。 【提出假设】 假设一:NO2与Na2O2不反应; 假设二:NO2能被Na2O2氧化; 假设三:______________________________________________。 【设计实验】 (1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。 (2)若假设二成立,则反应的化学方程式是_______________________。 (3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
|
|||||
| 24. | 详细信息 | ||||||||||||||||
|
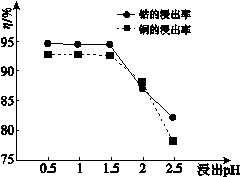
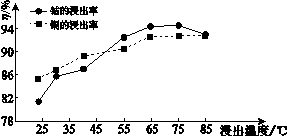
氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下: Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。 Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。 Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。 Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。 Ⅴ.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。 请回答: (1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是 ,加入Na2SO3溶液的主要作用是 。
①矿石粉末浸泡的适宜条件应是 、 。 ②图2中铜、钴浸出率下降的可能原因是 。 (3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式: ClO3− + + == Cl− + + (4)Ⅱ中,检验铁元素完全除去的试剂是 ,实验现象是 。 (5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是 、 。 (6)Ⅲ中,沉淀b的成分是MgF2 、 (填化学式)。 (7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是 。 |
|||||||||||||||||