江西省宜春市第九中学2020-2021年高一上册第二次月考化学题免费试卷在线检测
| 1. 选择题 | 详细信息 |
|
下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥蒸发 ⑦配制一定浓度的溶液,一定要用到玻璃棒的是 A.①②④⑥ B.①②③⑥ C.①②⑥⑦ D.①④⑤⑥ |
|
| 2. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数,下列说法正确的是 A.NO的摩尔质量是30 g B.标准状况下,1 mol H2O的体积是22.4 L C.17 g NH3含有的原子总数为4NA D.100 mL 0.1 mol/L Na2CO3溶液中,Na+的物质的量为 0.1 mol |
|
| 3. 选择题 | 详细信息 |
|
下列实验装置或操作与微粒的大小无直接关系的是( ) A.过滤  B.渗析 B.渗析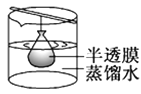 C.萃取  D.丁达尔效应 D.丁达尔效应 |
|
| 4. 选择题 | 详细信息 |
|
下列叙述中正确个数的是( ) ①标准状况下,6.02×1023个分子所占体积约是22.4L; ②1molH2O中含有2mol氢和2mol氧; ③0.012kg12C中含有约6.02×1023个碳原子; ④两种物质的物质的量相同,则它们在标准状况下的体积相同; ⑤同温同体积时,气体物质的物质的量越大,则压强越大; ⑥同温同压下,气体的密度与气体的相对分子质量成正比 ⑦2mol水的摩尔质量是1mol水的摩尔质量的2倍。 A.2个 B.3个 C.4个 D.5个 |
|
| 5. 选择题 | 详细信息 |
|
有关铝及其化合物的说法错误的是 A. 铁易生锈,而铝在空气中较稳定,所以铁比铝活泼 B. 可用铝壶烧开水,不可用其长期存放食醋、碱水 C. 氧化铝是一种较好的耐火材料,但不可用氧化铝坩埚熔化NaOH D. 氢氧化铝能中和胃酸,可用于制胃药 |
|
| 6. 选择题 | 详细信息 |
|
等质量的两块金属钠,一块直接投入水中,一块用刺有小孔的铝箔包好后投入水中(水均为足量),生成氢气( ) A.前者多 B.后者多 C.一样多 D.无法判断 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.钠与 B. C. D.在酒精灯加热条件下, |
|
| 8. 选择题 | 详细信息 |
|
某无色透明酸性液中,能大量共存的离子组是( ) A.NO C.Cu2+、Cl-、Ca2+、NO |
|
| 9. 选择题 | 详细信息 |
|
已知:8NH3+3Cl2=6NH4Cl+N2,下列说法不正确的是 A.该反应的氧化产物为N2 B.Cl2得电子,发生还原反应 C.该反应的氧化剂与还原剂物质之量之比为3∶8 D.通过该反应可说明Cl2的氧化性强于N2 |
|
| 10. 选择题 | 详细信息 |
|
能正确表示下列化学反应的离子方程式的是( ) A.氢氧化钡溶液与稀硫酸的反应OH+H+=H2O B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag D.石灰石溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2 |
|
| 11. 选择题 | 详细信息 |
|
在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( ) A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤ |
|
| 12. 选择题 | 详细信息 |
|
把过氧化钠投入含有HCO A.HCO |
|
| 13. 选择题 | 详细信息 |
|
可以根据5I- + A.I2是氧化产物,H2O是还原产物 B. C.该条件下氧化性: |
|
| 14. 选择题 | 详细信息 |
|
下列关于反应As2S3+O2+H2O→H3AsO4+S(未配平)的说法错误的是( ) A.每生成1 mol H3AsO4,转移2 mol e- B.氧化性:O2>S C.As2S3作还原剂,H3AsO4既是氧化产物又是还原产物 D.参与反应的O2和H2O的物质的量之比为5︰6 |
|
| 15. 选择题 | 详细信息 |
|
已知反应:①Cl2+ 2NaBr=2NaCl+ Br2 ;②KClO3+6HCl(浓)=KCl+ 3Cl2↑+ 3H2O;③2KBrO3+Cl2=2KClO3+Br2。下列说法正确的是( ) A.上述三个反应都是置换反应 B.反应②中氧化剂与还原剂的个数之比为1:6 C.反应③中若1个KBrO3反应,则还原剂得电子的数目为5 D.氧化性由弱到强的顺序为:Br2<Cl2<KClO3<KBrO3 |
|
| 16. 填空题 | 详细信息 |
根据所学知识回答下列问题: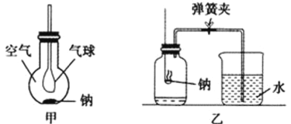 (1)如图甲所示,在平底烧瓶底部有一小块钠,剩余空间充有干燥的空气。过一段时间后可观察到银白色的钠变暗,发生反应的化学方程式为___________。 (2)如图乙所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为___________,产物的颜色是___________。 (3)若图乙的广口瓶中是铁丝在纯氧中燃烧,会观察到铁丝剧烈燃烧,火星四射,所得产物的化学式是___________。 |
|
| 17. 实验题 | 详细信息 |
|
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题: (1)上述仪器中,在配制稀H2SO4时用不到的有__________(填代号)。 (2)经计算,需浓H2SO4的体积为____________。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是__________(填代号)。 (3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到__________ mL的容量瓶中,转移时应用玻璃棒__________。转移完毕,用少量蒸馏水洗涤__________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度__________处。改用__________加蒸馏水到瓶颈刻度的地方,使溶液的__________。振荡、摇匀后,装瓶、贴签。 (4)在配制过程中,其他操作都准确,下列操作中:错误的是_______,能引起误差偏高的有______(填代号)。 ①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 ②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线 |
|
| 18. 填空题 | 详细信息 |
|
现有以下物质:①氢氧化钡②Cu③BaCO3④Fe(OH)3胶体⑤酒精⑥NH3⑦稀硫酸⑧Al2(SO4)3 (1)以上物质中属于混合物的是_________(填序号,下空同),属于电解质的是_________,能导电的是_________ (2)向④中逐滴滴加⑦,可观察到的现象是_________。 (3)写出物质⑧在水中的电离方程式_________。 (4)写出物质①和⑦反应的离子方程式_________。 (5)8.5g⑥约含有_________个分子,含_________mol质子。 (6)将34.2g⑧溶于水配成100mL溶液,从该溶液中取出10mL,其中 |
|
| 19. 填空题 | 详细信息 |
|
(1)填写关于物质的量计算的四个恒等式:n=______=______=______=_______。 (2)已知下列四个反应: A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2 C.Cl2+H2O=HCl+HClO D.C+H2O(g) 试从氧化还原的角度,回答下列问题: ①水只作氧化剂的是________; ②水只作还原剂的是________; ③水既不作氧化剂又不作还原剂的是________。 (3) KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O。 ①请配平上述化学方程式_____。 ②产生0.1molCl2,则转移的电子的物质的量为______mol。 |
|
最近更新



