2019河北高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( ) A.X原子和Y原子最外层都 B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2 C.X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子 D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
|
|
| 2. | 详细信息 |
|
下列原子中,第一电离能最大的是( ) A.B B.C C.Al D.Si
|
|
| 3. | 详细信息 |
|
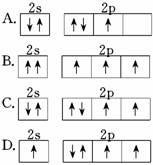
下列原子的电子排布图中,符合洪特规则的是( )
|
|
| 4. | 详细信息 |
|
A.X与Y形成化合物时,X可以显负价,Y显正价 B.第一电离能一定Y小于X C.最高价含氧酸的酸性:X对应的酸性强于Y对应的 D.气态氢化物的稳定性:HmY小于
|
|
| 5. | 详细信息 |
|
下列是几种原子的基态电子排布,电负性最大的原子是( ) A.1s22s22p4 B.1s22s22p63s23p3 C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
|
|
| 6. | 详细信息 |
|
某元素质量数51,中子数28,其基态原子未成对电子数为( ) A.0 B.1 C.2 D.3
|
|
| 7. | 详细信息 |
|
下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应且都产生H2的是 ( ) A.核内无中子的原子 B.外围电子排布为3s23p3的原子 C.最外层电子数等于倒数第三层的电子数的原子 D.N层上无电子,最外层的电子数等于电子层数的金属原子
|
|
| 8. | 详细信息 |
|
现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是( ) A.第一电离能:④>③>②>① B.原子半径:④>③>②>① C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
|
|
| 9. | 详细信息 |
|
下列关于价电子排布为3s23p4的原子描述正确的是( ) A.它的元素符号为O B.它的核外电 C.可以与H2化合生成液态化合物 D.其电子排布图为
|
|
| 10. | 详细信息 | |||||||||||||||
|
几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( ) A.X、Y元素的金属性X<Y B.一定条件下,Z单质与W的常见单质直接生成ZW2 C.Y的最高价氧化物对应的水化物能溶于稀氨水 D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
|
||||||||||||||||
| 11. | 详细信息 |
|
根据对角线规则,下列物质的性质具有相似性的是( ) A.氟和氩 B.铝和铁 C.铍和铝 D.铜和金
|
|
| 12. | 详细信息 |
|
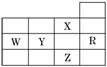
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.W元素的第一电离能小于Y元素的第一电离能 B.Y、Z的阴离子电子层结构都与R原子的相同 C.p能级未成对电子最多的是Z元素 D.X元素是电负性最大的元素
|
|
| 13. | 详细信息 |
|
主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为( ) A.ns2和ns2np4 B.ns1和ns2np4 C.ns2和ns2np5 D.ns1和ns2
|
|
| 14. | 详细信息 |
|
对Na、Mg、Al的有关性质的叙述正确的是( ) A.碱性:NaOH<Mg(OH)2<Al(OH)3 B.第一电离能:Na<Mg<Al C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
|
|
| 15. | 详细信息 |
|
下列各组元素性质的递变情况错误的是( ) A B.P、S、Cl元素最高正价依次升高 C.N、O、F电负性依次增大 D.Na、K、Rb第一电离能逐渐增大
|
|
| 16. | 详细信息 |
|
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( ) A.Y的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物
D.X、Y两元素形成的化合物为离子化合物
|
|
| 17. | 详细信息 |
|
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布为msnmpn; ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。 请回答下列问题: (1)Z2+的核外电子排布式是________。 (2)Q与Y形成的最简单气态氢化物分别为甲、 a.稳定性:甲>乙 b.稳定性:甲<乙 (3)Q、R、Y三种元素的第一电离能数值由小至大的顺序为________(用元素符号作答)。 (4)五种元素中,电负性最大的元素是________。
|
|
| 18. | 详细信息 |
|
A、B、C、D、E、F均为 (1)推断B在元素周期表中的位置:第________周期,第________族。 (2)写出F的电子排布式:_____________________________________________________。 (3)C、D可形成淡黄色的粉末,其电子式为______________________________________。 (4)写出A与C形成的10电子微粒的化学式:________、________、_____
|
|
| 19. | 详细信息 |
|
A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知B的最外电子层是ns2npn+1;C的p轨道上未成对的电子比B少一个,D的二价阳离子与C的阴离 (1)B核外电子排布式为_________________ (2)A与E化合时原子间以________键相结合,D与C化合时以________键相结合。 (3)写出A、C的单质直接形成的化合物与E的单质反应的离子方程式:_________。 (4)写出B和D形成的化合物遇水时发生反应的方程式:___________________。
|
|
| 20. | 详细信息 | ||||||||||
|
有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写: (1)A原子的核外电子排布式____________________________________________。 (2)B元素在周期表中的位置_____ (3)C原子的电子排布图是________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。 (4 (5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为________________________________ ________________________________________________________________________。 与D的氢化物的水化物反应的化学方程式为_______________ ________________________________________________________________________。
|
|||||||||||
| 21. | 详细信息 |
|
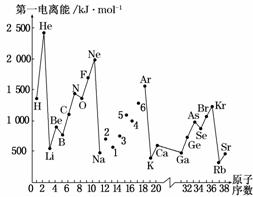
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题: (1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图像。 (2)从上图分析可知,同一主族元素原子的第一电离能I1的变化规律是______________。 (3)上图中5号元素在周期表中的位置是_______ (4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_____________________________________________________________ ________________________________________________________________________。 (5)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519 kJ·mol-1,失去第二个电子为7 296 kJ·mol-1,失去第三个电子为11 799 kJ·mo
|
|
| 22. | 详细信息 | |||||||||||||||||||||||||||||||||||
|
不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的X值。
(1)通过分析X值的变化规律,确定N、Mg的X值范围:________<X(Mg)<________;________<X(N)<_ (2)推测X值与原子半径的关系是________________________________________。 (3)某有机物结构简式为 (4)经验 (5)预测元素周期表中,X值最小的元素位置________(放射性元素除外)。
|
||||||||||||||||||||||||||||||||||||