2020西藏高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
运输汽油的车上,贴有的危险化学品标志是( ) A. |
|
| 2. | 详细信息 | ||||||||
|
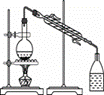
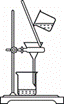
下列实验装置与实验对应的是( )
|
|||||||||
| 3. | 详细信息 |
|
配制一定物质的量浓度的溶液,如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液实际浓度与所要求的相比( ) A.偏大 B.偏小 C.不变 D.无法确定 |
|
| 4. | 详细信息 |
|
用NA表示阿伏伽德罗常数的值,下列叙述正确的是( ) A.标准状况下,22.4 L H2O的质的量为1mol B.16 g O2的物质的量为1mol C. 16 g O2中含有的氧原子数为1mol D.物质的量浓度为0.5 mol·L-1 MgCl2 溶液中,Cl-浓度为0.5 mol·L-1
|
|
| 5. | 详细信息 |
|
设阿伏加德罗常数的值为NA。关于1mol H2O的叙述正确的是( ) A.含有1mol H2 B.含有NA个水分子 C.质量为18 g/mol D.在标准状况下的体积为22.4 L |
|
| 6. | 详细信息 |
|
下列离子方程式书写正确的是( ) A.盐酸与 硝酸银反应: H++Cl-+ Ag++NO3—== HNO3+ AgCl↓ B.硫酸钠与氢氧化钡反应:SO42- + Ba2+ == BaSO4↓ C.大理石与盐酸反应:CO32—+2H+ == H2O + CO2↑ D.稀硫酸与氢氧化钠反应:SO42- + H+ + 2Na+ + 2OH- ==Na2SO4↓ + 2H2O |
|
| 7. | 详细信息 |
|
关于CuSO4溶液和Fe(OH)3胶体描述正确的是 ( ) A.两者都能产生丁达尔效应 B.两者都不能产生丁达尔效应 C.CuSO4溶液能产生丁达尔效应,Fe(OH)3胶体不能产生丁达尔效应 D.CuSO4溶液不能产生丁达尔效应,Fe(OH)3胶体能产生丁达尔效应 |
|
| 8. | 详细信息 |
|
下列反应属于氧化还原反应的( ) A.H2SO4+2NaOH=Na2SO4+2H2O B.2NaHCO3 C.NH3+HCl=NH4C1 D.CuO+H2 |
|
| 9. | 详细信息 |
|
2Na+2H2O===2NaOH+H2↑,下列说法中正确的是 ( )。 A.Na是氧化剂 B.Na既是氧化剂,又是还原剂 C.Na是还原剂 D.H2O是还原剂 |
|
| 10. | 详细信息 |
|
下列关于金属的叙述中正确的是( ) A.所有的金属都是固态的 B.金属具有导电性、导热性和延展性 C.所有金属都不能与碱反应 D.金属元素在自然界中都是以化合态存在的 |
|
| 11. | 详细信息 |
|
下列关于Na2O和Na2O2的叙述正确的是( ) A.Na2O与Na2O2均可与水反应产生氧气 B.Na2O与Na2O2分别与CO2反应的产物完全相同 C.Na2O与Na2O2均为碱性氧化物 D.在呼吸面具中,Na2O2常做供氧剂,而Na2O不能 |
|
| 12. | 详细信息 |
|
下列有关碳酸氢钠和碳酸钠的说法正确的是( ) A.加热时均可以分解产生气体 B.与盐酸反应的离子反应方程式一样 C.都可以与反应生成气体 D.碳酸钠俗称小苏打 |
|
| 13. | 详细信息 |
|
下列关于Al(OH)3的性质的叙述错误的是( ) A.Al(OH)3是难溶于水的白色沉淀 B.Al(OH)3不能溶于氢氧化钠 C.Al(OH)3能溶于盐酸 D.Al(OH)3属于两性氢氧化物 |
|
| 14. | 详细信息 |
|
下列有关铁及其化合物的说法中正确的是( ) A.铁与水蒸气在高温下的反应产物为Fe2O3和H2 B.氢氧化亚铁是红褐色沉淀 C.Fe3+与KSCN溶液产生红色沉淀 D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
|
| 15. | 详细信息 |
|
.以下有关焊锡(锡和铅)的结论正确的是( ) A.焊锡的熔点比锡和铅的熔点低 B.焊锡的熔点比锡和镉的熔点低 C.焊锡的熔点比锡和铋熔点低 D.焊锡的熔点比铅、锡的熔点都高 |
|
| 16. | 详细信息 |
|
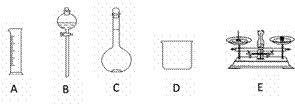
现用Na2SO4固体来配制480 mL 0.2mol·L-1的Na2SO4溶液。可供选择的仪器如下图
(1)如图所示的仪器中配制溶液不需要的是____、____ (填选项),配制上述溶液还需用到的玻璃仪器是___________(填仪器名称)。(6分) (2)使用容量瓶之前必须进行的操作是________。(填选项)(2分) A.检查气密性 B.检查是否漏水 C.烘干 (3)经计算,需Na2SO4的质量为_____g。(2分) (4)你选用的容量瓶规格为______ml。(2分) (5)配制溶液时,一般可分为以下几个步骤: ①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 其操作顺序:②→___→___→___→___→____→___ (填序号)。(6分) (6)在配制过程中,其他操作都准确,定容时俯视刻度线会使所配溶液浓度________ (填“偏高”、“偏低”或“无影响”) (2分) |
|
| 17. | 详细信息 | ||
|
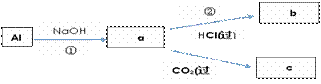
钠、铝、铁是三种重要的金属。请回答: (1)三种金属与同浓度盐酸反应,反应最慢的是____(填选项)。(2分) a.钠 b.铝 c.铁 (2)金属钠与水发生反应的离子方程式为_______;(填选项)(2分) a.2Na +2 H2O == 2NaOH+H2↑ b.2Na + 2H2O == 2Na++2OH—+H2↑ c.2Na + 2H2O == 2Na++2OH—+O2↑ (3)可观察到的实验现象正确的是________(填选项)。(2分) a.钠沉到水底 b.钠熔成小球 c.小球四处游动 (4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);(8分) NaOH(过) a:____________,b: _____________,c:____________; ①____________________________________________; (5)Fe跟Cl2在一定条件下反应,所得产物为________。(2分) (6)将该产物溶于水配成溶液,分装在两支试管中。请回答:(4分) a.若向其中一支试管中滴加KSCN溶液,则溶液变成_____色。 b.向另一支试管中滴加NaOH溶液,产生__________色沉淀。 |
|||
| 18. | 详细信息 |
|
请根据物质的量的相关公式,完成下列问题。(注意书写单位) (1)3.01×1023 个NH3分子的物质的量__________。(3分) (2)0.5molH2SO4含有的氧原子的物质的量___________。(3分) (3)2.3gNO2的物质的量__________。(3分) (4)标况下,33.6LN2的物质的量______。(3分) (5)0.5mol K2SO4中,c(K+)=___________。(3分)
|
|
 B.
B. C.
C. D.
D.