2020甘肃高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列有关实验室一般事故的预防和处理方法正确的是 A.燃着的酒精灯打翻失火,应立即用水浇灭 B.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 C.蒸发食盐溶液时,发生液滴飞溅现象, D.皮肤上沾有少量浓硫酸,可立即用大量水冲洗,涂上3%~5%的NaHCO3溶液
|
|
| 2. | 详细信息 |
|
用下列实验装置进行相应实验,能达到实验目的的是
①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 ②用图2所示装置从氯化钠溶液中得到氯化钠晶体 ③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳 ④用图4所示装置从乙醇与苯的混合物中分离出苯 A.①② B.②③ C.②③④ D.①③④
|
|
| 3. | 详细信息 |
|
在1L溶有0.2molNaCl和0.1molMgCl2的溶液中,Cl−的物质的量浓度为 A.0.05mol/L B.0.1mol/L C.0.2mol/L D.0.4mol/L
|
|
| 4. | 详细信息 |
|
下列说法正确的是 A.温度相同、体积相同的O2(g)和N2(g)分子数之比为1:1 B.温度相同、压强相同的SO2(g)和CO2(g)密度之比为11:16 C.温度相同、压强相同、质量相同的O2(g)和H2(g)体积之比为1:16 D.温度和容积相同的两容器中分别盛有5molO2(g)和2molN2(g),压强之比为2:5
|
|
| 5. | 详细信息 |
|
下列各物质中加入适量的稀盐酸,不能将杂质除掉的是 A.氯化钠中混有少量碳酸钠 B.硫酸钠中混有少量碳酸钙 C.铜粉中混有少量铁屑 D.氯化钾中混有少量氢氧化钾
|
|
| 6. | 详细信息 |
|
厦钨股份公司拟生产用于汽车贮氢的钨合金,此合金 A.熔点比钨高 B.不能导电 C.具有金属特性 D.是一种不可回收物
|
|
| 7. | 详细信息 |
|
下列反应的离子方程式不正确的是 A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O B.用小苏打治疗胃酸过多:HCO3−+H+ =CO2↑+H2O C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl− D.过氧化钠与水反应:2Na2O2+2H2O=4OH−+O2↑
|
|
| 8. | 详细信息 |
|
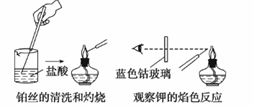
焰色
A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质 B.钾的焰色实验要透过蓝色钴玻璃观察 C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化 D.没有铂丝可用无锈铁丝代替进行实验
|
|
| 9. | 详细信息 |
|
下列实验设计及其对应的离子方程式均正确的是 A.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ B.Na与H2O反应制备H2:2Na+2H2O=2Na++2OH−+H2↑ C.用小苏打治疗胃酸过多:CO32−+2H+=CO2↑+H2O D.用食醋除去水瓶中的水垢:CO32−+2H+=CO2↑+H2O
|
|
| 10. | 详细信息 |
|
下列关于铝及其化合物叙述中,正确的是 A.不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 C.氯化铝溶液与NaOH溶液互滴现象完全相同 D.纯铝比铝合金的硬度更大、熔点更低
|
|
| 11. | 详细信息 |
|
下列关于氯水的叙述中,正确的是 A.新制氯水中有3种分子,有4种离子 B.新制氯水在光照的条件下,可以产生气体,该气体是氯气 C.向新制氯水中滴加硝酸银溶液,没有任何现象 D.新制氯水不可以使干燥的有色布条褪色
|
|
| 12. | 详细信息 |
|
.在硫酸溶液中,NaClO3和Na2SO3能按粒子个数之比1:2完全反应,生成一种棕黄色气体 X,同时Na2SO3被氧化为Na2SO4,则X为 A.Cl2 B.Cl2O7 C.ClO2 D.Cl2O
|
|
| 13. | 详细信息 |
|
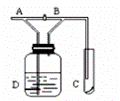
如图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是
A.浓硫酸 B.NaOH溶液 C.水 D.NaCl溶液
|
|
| 14. | 详细信息 |
|
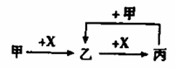
已知甲、乙、丙和X是四种中学化学中常见的物
A.甲为C,X是O2 B.甲为SO2,X是NaOH溶液 C.甲为 Fe,X 为 Cl2 D.甲为AlCl3,X为NaOH溶液
|
|
| 15. | 详细信息 |
|
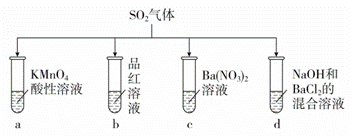
将SO2分别通入下列各溶液中,下列有关说法正确的是
A.试管a中实验可以证明SO2具有漂白性 B.试管b中溶液褪色,说明SO2具有强氧化性 C.试管c中能产生白色沉淀,说明SO2具有还原性 D.试管d中能产生白色沉淀,加
|
|
| 16. | 详细信息 |
|
向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是 A.11.2g B.5.6g C.2.8g D.无法计算
|
|
| 17. | 详细信息 |
|
按要求回答下列问题 (1)①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧二氧化碳 ⑨液态氯化氢 ⑩硫酸溶液。上述物质中能导电的是___________(填编号,下同),属于电解质的是___________,属于非电解质的是____________。 (2)3.01×1023个NH4+含有质子的物质的量是__________,含有电子的物质的量是__________。 (3)200mL 2mol/L的Al2(SO4)3溶液中SO42−的物质的量浓度为__________。 (4)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为_____________。 (5)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为___________。 (6)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是_________。
|
|
| 18. | 详细信息 |
|
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500°C时隔绝空气加热完全分解。回答下列问题: (1)硫酸亚铁铵晶体隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________________。 (2)为检验分解产物的成分,设计如下实脸装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是_______________________________。 ②为检验A中残留物是否含有FeO,需要选用的试剂有______________(填标号)。 A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液 (3)通入酸性高锰酸钾溶液,溶液褪色,该反应中SO2表现出化学性质是______________。
|
|
| 19. | 详细信息 |
|
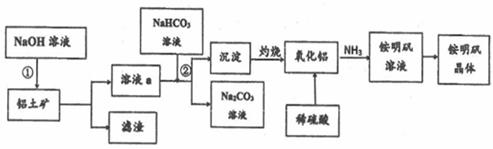
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。 (1)铝粉和铁的氧化物(FeO−Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 ____________________________。 (2)以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。
①实验前,要将铝土矿粉粹的目的是_______。 ②用氧化物的形式表示铝硅酸钠的化学式________。 ③步骤②涉及到的离子方程式是_______。 ④写出利用Al2O3制备金属Al的化学方程式:_______。 ⑤若同时制取铵
|
|
| 20. | 详细信息 |
|
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答: (1)写出步骤Ⅰ反应的离子方程式:____ (2)试剂X是______________。溶液D是______________。 (3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
(4)由固体F制取硫酸铜溶液,通常有两种方案: 方案一:将固体F在加热条件下与浓硫酸反应; 方案二:将固体F投入热的稀浓硫酸中,然后通入氧气; 方法一的缺点为:_______________________ (5)工业上常用溶液E制得净水剂Na2FeO4,流程如下:
①测得溶液E中c(Fe2+)为0.2 mol·L−1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液_______kg。 ②写出由Fe(OH)3制取Na2FeO4的离子方程式______________。(已知N
|
|
| 21. | 详细信息 |
|
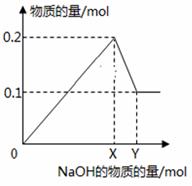
在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
(1)OX段反应的离子方程式为______________________。 (2)XY段反应的离子方程式为______________________。 (3)生成Mg(OH)2的质量为___________________g。 (4)X=________________;Y
|
|