2019四川高二下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下面的“诗”情“化”意,分析正确的是( ) A. “日照遂州江雾开”中伴有丁达尔效应 B. 杜康用高粱酿酒的原理,是通过蒸馏法将高梁中的乙醇分离出来 C. “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化 D. “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应
|
|
| 2. | 详细信息 |
|
大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
A. NO2不是酸性氧化物 B. O2和O3是氧的两种同素异形体 C. 反应I属于氧化还原反应 D. 烟雾是一种固溶胶,其分散剂是空气
|
|
| 3. | 详细信息 |
|
下列化学用语正确的是( ) A. CCl4的比例模型: C. 水的电离方程式:2H2O=H3O++OH- D. 小苏打的化学式:Na2CO3
|
|
| 4. | 详细信息 |
|
下列说法错误的是( ) A. 2-甲基丁烷也称异丁烷 B. 同系物的化学性质一定相似 C. 常温下乙酸乙酯在水中的溶解性小于乙醇 D. 石蜡油裂化后产生的气体能使溴的CCl4溶液褪色
|
|
| 5. | 详细信息 |
|
25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是( ) A. 3种溶液中pH最小的是① B. 3种溶液中水的电离程度最大的是③ C. ①与②等体积混合后溶液显酸性 D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
|
|
| 6. | 详细信息 |
|
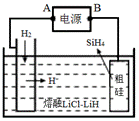
用粗硅作原料,熔融盐电解法制取硅烷原理如图。下列叙述正确的是( )
A. 电源的B极为负极 B. 可选用石英代替粗硅 C. 电解时,熔融盐中Li+向粗硅移动 D. 阳极反应:Si+4H--4e-=SiH4↑
|
|
| 7. | 详细信息 |
|
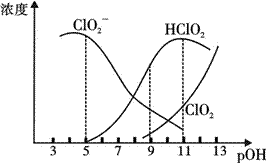
亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是
A. HClO2的电离平衡常数的数值Ka=10-8 B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH- C. pH=7时,溶液中含氯微粒 D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
|
|
| 8. | 详细信息 |
|
电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )
A. 当B外接电源负极时,膜由无色变为蓝色 B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3 C. 当A接电源的负极时,此时Li+得到电子被还原 D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
|
|
| 9. | 详细信息 |
|
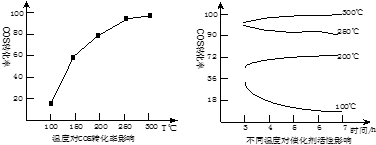
氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为: ①氢解反应:COS(g) +H2(g) ②水解反应:COS(g) +H2O(g) 请回答下列问题: (1)氧硫化碳的电子式为_____。 (2)CO和H2O(g)能反应生成CO2和H2,写出该反应 (3)水解反应达到平衡后,若减小容器的体积,逆反应速率将_____(填增大、减少或不变,下同),COS的转化率____。 (4)某温度下,体积为2L的恒容体系中,物质的量分别为mmol、nmol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K= ____(用m、n、α等符号表示)。 (5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图
COS水解的最佳温度是________;理由是___________。
|
|
| 10. | 详细信息 |
|
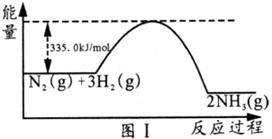
.碳和氮的氢化物是广泛的化工原料,回答下列问题: (1)工业上合成氨的反应为N2(g)+3H2(g)
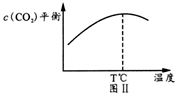
①氨分解:2NH3(g) ②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______ (2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1 已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3 上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。 (3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下: i.CH4(g)+H2O(g) ii.CO(g)+ H2O(g) 在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题: ①下列可判断体系达到平衡状态 A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D. ②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。 ③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。
|
|
| 11. | 详细信息 |
|
周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应 已知: 现有一种内酯I(含两个五元环)的合成路线如下(A~I均表示一种有机化合物):
回答下列问题: (1)化合物A中含有的官能团名称是_____,D的分子式为______。 (2)由C生成D的反应类型为______,A形成高聚物的结构简式为_____。 (3)写出F与足量银氨溶液反应的化学方程式_______。 (4)化合物H的系统命名为_____。 (5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为_____。 (6)在化合物I的同分异构体中能同时符合下列条件的是_____(填写结构简式)。 ①具有酚结构;②仅有一种官能团;③具有4 种氢原子 (7)2,5-二甲基四氢呋喃(
|
|
| 12. | 详细信息 |
|
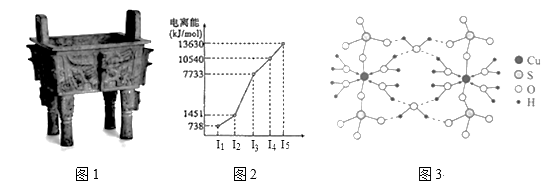
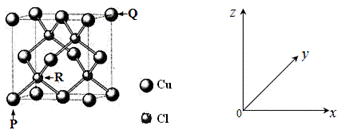
中国是最早发现并使用青铜器 (1)Cu原子的外围电子排布式为_____。 (2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是____,I3远大于I2的原因是______。
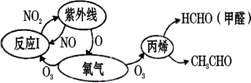
(3)图3是某含铜配合物的晶体结构示意图。 ①晶体中H2O和SO42-的中心原子的杂化类型为_____,试判断H2O和SO42-的键角大小关系并说明原因_____。 ②图3中的氢键有(H2O)O—H···O(H2O)和_______。 ③写出该配合物的化学式_______。 (4)一种铜的氯化物晶胞结构如图所示。
该化合物的化学式为______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、(
|
|

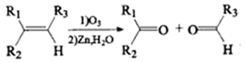 ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。