2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可制备出超高强度的高性能混凝土。下列关于二氧化硅的说法中,正确的是( ) A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 B.将二氧化碳通入硅酸钠溶液可以得到硅酸 C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 D.二氧化硅是酸性氧化物,它不溶于任何酸
|
|
| 2. | 详细信息 |
|
下列各组物质中,肯定全都属于纯净物的是 A.液氯和氯水 B.漂白粉和乙醇 C.饱和食盐水和硫酸亚铁 D.干冰和混有冰的水
|
|
| 3. | 详细信息 |
|
下列说法不正确的是 A.麦芽糖及其水解产物均能发生银镜反应 B.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH C.花生油既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 D.用甘氨酸
|
|
| 4. | 详细信息 |
|
下列微粒中,其核外电子数相同
A.①②③ B.②③④ C.①②④ D.①③④
|
|
| 5. | 详细信息 |
|
物质的量浓度相同的NaCl、MgCl2、AlCl3 3种溶液,当它们的体积比为3:2:1时,3种溶液中Cl―的物质的量之比为( ) A、1:1:1 B、1:2:3 C、3:2:1 D、3:4:3
|
|
| 6. | 详细信息 |
|
16.4g NaOH和NaHCO3的固体混合物投入150ml 2.0mol·L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的物质的量为多少 ( ) A.2.0mol·L-1 B.0.41 mol C.0.30 mol D.无法计算
|
|
| 7. | 详细信息 |
|
下列叙述正确的是 A.电解NaCl溶液时,阴极产生1 mol Cl2的同时阳极产生l molH2 B.0.1 mol·L-1 AlCl3溶液中Al3+的浓度为0.1 mol·L-1 C.7 g 14C中所含中子数为4 NA(设NA为阿伏加德罗常数的值) D.2.24 L氯气与足量NaOH稀溶液反应,转移0.1 mol电子
|
|
| 8. | 详细信息 |
|
鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为 A.C30H60 B.C30H50 C.C30H56 D.C30H52
|
|
| 9. | 详细信息 |
|
以下试剂不能鉴别H2S和SO2的是 A.NaOH溶液 B.滴有淀粉的碘水 C.CuSO4溶液 D.品红溶液
|
|
| 10. | 详细信息 |
|
常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是 A.该溶液一定呈酸性 B.该溶液一定呈碱性 C.该溶液中一定有C(OH-) = 0.1mol/L D.该溶液的pH值为1或13
|
|
| 11. | 详细信息 |
|
已知1 g CH4完全燃烧生成CO2和液态水时放出55.6 kJ的热量,则下列甲烷燃烧的热化学方程式正确的是 A.CH4+CO2==CO2+2H2O ΔH =-889.6 kJ·mol-1 B.CH4(g)+2O2(g)==CO2(g)+2H2O(g)ΔH =-889.6 kJ·mol-1 C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH =+889.6 kJ·mol-1 D.CH4(g)+2O2(g)==CO2(g)+2H2O(l)ΔH =-889.6 kJ·mol-1
|
|
| 12. | 详细信息 |
|
下列叙述不正确的是( ) A.低碳生活(low-carbon life)是一种时尚的生活理念,倡导减少温室气体排放。CO2、CH4等是常见的温室气体 B.新型无机非金属材料用途广泛,人造刚玉用做高温炉管、氮化硅陶瓷可用于制造柴油机发动机部件 C.推广可利用太阳能、风能的城市照明系统,积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料, 利于发展低碳经济、循环经济 D.“显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为126g
|
|
| 13. | 详细信息 |
|
某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是 A.氧化性:ClO->I2>SO42- B.淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 C.蓝色消失的原因是Na2SO3溶液具有漂白性 D.若将Na2SO3溶液加入氯水中,氯水褪色
|
|
| 14. | 详细信息 |
|
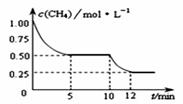
在密闭容器中进行反应CH4(g)+H2O(g)
A.0~5 min内,v(H2)=0.1 mol·(L·min)-1 B.反应进行到12min时,CH4的转化率为25% C.恒温下,缩小容器体积,平衡后H2浓度减小 D.10 min时,改变的外界条件可能是升高温度
|
|
| 15. | 详细信息 |
|
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。 (1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。 已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol 则E(H-Cl)= ; (2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol 3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol 请写出CO还原FeO的热化学方程式: ; 最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。 ①电池的正极反应式为 ____ ; ②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
|
|
| 16. | 详细信息 |
|
纳米级Cu2O具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。已知Cu+易在酸性条件下发生:2Cu+=Cu2++Cu。 方法一:在新制Cu(OH)2浊液中滴入N2H4·H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。 (1)写出上述制备过程中的总反应方程式 。 (2)用甲醛稀溶液代替N2H4·H2O水溶液也可以实现上述转化,但需水温较高,且往往会生成极少量颗粒较大的Cu2O,用 的方法可分离出颗粒过大的Cu2O。 方法二:以铜作阳极,石墨作阴极电解。已知:①铜作阳极时,铜先被氧化生成Cu+,后Cu+继续氧化生成Cu2+;②在碱性溶液中CuCl浊液易转化为Cu2O。 (3)以NaOH溶液作为电解质溶液时需添加NaCl,其目的是 ,写出阳极反应方程式 。 (4)写出在碱性溶液中CuCl浊液转化为Cu2O的离子方程式 。 (5)这样制得的Cu2O中往往含有CuCl,请设计实验证明CuCl的存在 。
|
|
| 17. | 详细信息 | ||||
|
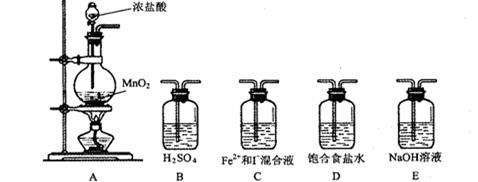
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱。 【提出假设】 假设1: ; 假设2: ; 假设3:Fe2+和I-的还原性一样强。 【验证假设】 ⑴ 利用以下装置进行试验,
⑵ 实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。 ⑶ 请在下表中填写实验步骤及预期现象与结论。
⑷该实验成功的关键是控制各反应物的用量。该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设, 通入的氯气的体积最多不能超过 。(标准状况) ⑸ 有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小。并不能证明Fe2+和I-的还原性强弱。于是提出另一验证方案:往KI溶液中滴加 溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是 。
|
|||||
| 18. | 详细信息 |
|
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL0.25 mol/L的稀H2SO4。 可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙。 请回答下列问题: (1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。 (2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,应选用的量筒是 (填代号)。 (3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度处。改用 加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。 (4)在配制过程中,其他操作都准确,下列操作中:能引起误差偏高的有 (填代号)。 ①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 ②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线
|
|
| 19. | 详细信息 |
|
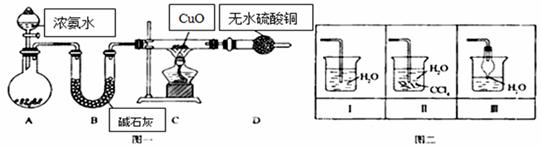
氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质。
(1)装置A中烧瓶内试剂可选用 (填序号).B的作用是 . a.碱石灰 b.生石灰 c.浓硫酸 d.烧碱溶液 (2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ). Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C (3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 .该反应证明氨气具有 性. (4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号). (5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为_______mol/L.
|
|
| 20. | 详细信息 |
|
今有Fe和Zn的混合物12.1g,与足量的稀盐酸反应,共放出H2 4.48L(标准状况)。 求:(1)原混合物中Fe的质量分数。 (2)消耗HCl的物质的量。
|
|
| 21. | 详细信息 |
|
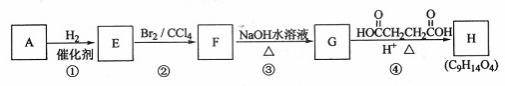
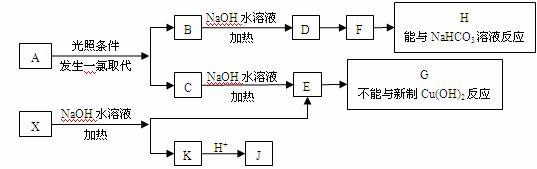
有机化合物A~H的转换关系如下所示:
请回答下列问题: (1)烃A常用来焊接或切割金属,在相同状况下它的密度是氢气的13倍,则A 的名称是 ; (2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;反应类型是 (3)F转化为G得化学方程式是 ;反应类型是 ; (4)标准状况下,1mol G与足量的金属钠反应放出气体的体积为 L; (5)链烃B是A的同系物, B分子中的所有碳原子共直线,且1mol的B完全燃烧消耗5.5mol的氧气,写出B的结构简式 ; (6)链烃C是B的一种同分异构体,且它们属于官能团异构,则C的结构简式为 。
|
|
| 22. | 详细信息 |
|
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的代基。在一定条件下有如下的转化关系:(无机物略去)
(1)A物质的名称为:________________。写出三种属于芳香烃类的A的同分异构体__________________、_______________、______________。(不包括A,写结构简式) (2)J中所含的含氧官能团的名称为_____________________________________。 (3)F与新制的氢氧化铜悬浊液反应的化学方程式是________ __________________;反应类型是__________。 (4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是___________。 (5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。 ①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。________________________________________
|
|
| 23. | 详细信息 |
|
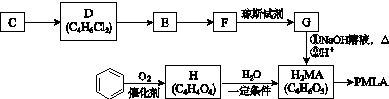
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。 Ⅰ.用乙炔等合成烃C。
已知:R-C≡CH+COR′H (1)A分子中的官能团名称是_______________。 (2)A的一种同分异构体属于乙酸酯,其结构简式是__________________________。 (3)B转化为C的化学方程式是______________________ , 其反应类型是_________________。 Ⅱ.用烃C或苯合成PMLA的路线如下。
已知:R—CH2OH (4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式的结构简式是________________。 (5)E的结构简式是________________。 (6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________。 (7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种):_____________________。
|
|