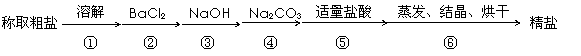高二上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列说法正确的是( ) A.可用丁达尔现象区分溶液与胶体B.生石灰与水混合的过程只发生物理变化 C.胶体是一种纯净物 D.CuSO4·5H2O是一种混合物
|
|
| 2. | 详细信息 |
|
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是( ) A、反应进行的方向 B、反应的快慢 C、反应进行的限度 D、反应物的多少
|
|
| 3. | 详细信息 |
|
下列物质中,能够导电的电解质是( ) A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖
|
|
| 4. | 详细信息 |
|
有下列仪器:①烧杯;②锥形瓶;③圆底烧瓶; ④试管;⑤坩埚,其中可以用酒精灯直接加热的仪器是( ) A.①②③④ B.④⑤ C.①③ D.④
|
|
| 5. | 详细信息 |
|
下列说法中正确的是 A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时, 反应为吸热反应 C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 D.ΔH的大小与热化学方程式的计量系数无关
|
|
| 6. | 详细信息 |
|
下列关于钠的叙述中,不正确的是( ) A.钠燃烧时发出黄色的火焰,生成过氧化钠 B.钠应保存在煤油中 C.钠有很强的还原性 D.金属钠着火时,可以用水灭火
|
|
| 7. | 详细信息 |
|
下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( ) A.CO2(CO):O2 B.MgO (Al2O3):NaOH溶液 C.NaHCO3溶液(Na2CO3):过量的CO2 D.CO2(HCl):饱和NaHCO3溶液
|
|
| 8. | 详细信息 |
|
在物质分类中,前者包括后者的是( ) A.氧化物、化合物 B.化合物、电解质C.溶液、 胶体 D.溶液、 分散系
|
|
| 9. | 详细信息 |
|
下列关于反应热的说法正确的是 A.当∆H为“-”时,表示该反应为吸热反应 B.已知C(s)+ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
|
|
| 10. | 详细信息 |
|
以下说法正确的是( ) A.物质所含元素化合价升高的反应叫还原反应 B.在氧化还原反应中,失去电子的元素化合价降低 C.物质中某元素失去电子,则此物质是氧化剂 D.还原剂中必定有一种元素被氧化
|
|
| 11. | 详细信息 |
|
下列离子方程式正确的是( ) A. 铁跟稀硫酸反应:2Fe + 6H+ = 2Fe3+ +3H2 ↑ B. 氢氧化钡跟盐酸反应:H++OH-=H2O C.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓
|
|
| 12. | 详细信息 |
|
若NA表示阿伏加德罗常数,下列说法正确的是( ) A.14g氮气中含有7NA个电子B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子 C.1 mol Cl2作为氧化剂得到的电子数为NA D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7︰4
|
|
| 13. | 详细信息 |
|
在某无色透明的酸性溶液中,能大量共存的离子组是( ) A.Na+ 、K+、SO42-、HCO3- B.Cu2+、K+、SO42--、NO3- C.Na+、 K+、Cl-、 NO3- D.Fe3+、K+、SO42-、Cl-
|
|
| 14. | 详细信息 |
|
已知下列热化学方程式: (1)CH3COOH (l)+2O2 (g) == 2CO2 (g)+2H2O (l) ΔH1=-870.3 kJ·mol-1 (2)C (s)+ O2 (g) == CO2 (g) △H2=-393.5 kJ•mol-1 (3)H2 (g) + 则反应2C (s)+2H2 (g) +O2 (g) == CH3COOH (l)的△H为( ) A. -488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1
|
|
| 15. | 详细信息 |
|
一定条件下,可逆反应C(s) + CO2(g) ①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。 上述措施中一定能使反应的正反应速率显著加快的是 A.①②③④ B.①③ C.①② D.①③④
|
|
| 16. | 详细信息 |
|
对可逆反应4NH3(g)+ 5O2(g) A.达到化学平衡时,4υ正(O2)= 5υ逆(NO ) B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
|
|
| 17. | 详细信息 |
|
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: ① Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= —24.8 kJ•mol-1 ② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= —47.2 kJ•mol-1 ③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1 写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: __________________________________________________。
|
|
| 18. | 详细信息 | ||||||||||
|
氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1 NaCl溶液。请回答问题。
|
|||||||||||
| 19. | 详细信息 |
|
丙烷燃烧可以通过以下两种途径: 途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1 途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1 2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1 2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值) 请回答下列问题: (1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量 (2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________ (3)“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍
|
|
| 20. | 详细信息 | ||
|
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备 精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐 (2)判断BaCl2已过量的方法是( ) A.取②后的上层清液少许放入试管中,再滴入几滴Na2SO4溶液,若溶液未变浑浊,则证明BaCl2已过量。 B.取②后的上层清液少许放入试管中,再滴入几滴BaCl2溶液,若溶液未变浑浊,则 证明BaCl2已过量。 C.取②后的上层清液少许放入试管中,再滴入几滴AgNO3溶液,若溶液变浑浊,则证 明BaCl2已过量。 D.取②后的上层清液少许放入试管中,再滴入几滴BaCl2溶液,若溶液变浑浊,则证 明BaCl2已过量。 (3)写出④中相应的离子方程式 , 。
|
|||
| 21. | 详细信息 |
|
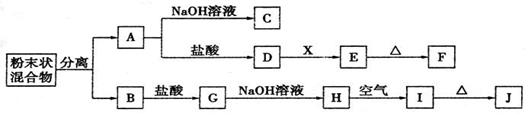
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
(此转化关系中所用的试剂都是足量的) (1)写出下列物质的化学式:F ,G 。 (2)将混合物中两种金属分离开的最简单的方法是 。 (3)D→E的转化中,加入过量的X可能是 。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C: ; H→I: 。
|
|
| 22. | 详细信息 |
|
在一定条件下,CH4 和CO的燃烧的热化学方程式分别为: CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol 2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol 一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比。
|
|