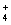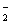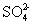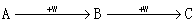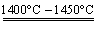湖南省各市名校2020-2021年高一下学期化学期末考试试题含详解
| 1. | 详细信息 |
|
下列做法正确的是 A . 回收厨余垃圾,提取食用油 B . 改变生活方式,减少废弃物产生 C . 回收电子垃圾,集中填埋处理 D . 焚烧废旧塑料,防止白色污染 |
|
| 2. | 详细信息 |
|
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量的变化,据此判断以下叙述中错误的是 A . 金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低 B . 物质的燃烧可看成 “ 贮存 ” 在物质内部的部分化学能转化为热能释放出来的过程 C . 氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很稳定 D . 需要加热才能发生的反应一定是吸热反应 |
|
| 3. | 详细信息 |
|
化学与人类生活、生产和社会可持续发展密切相关,下列说法不正确的是 A . 为方便运输可用钢瓶储存浓硫酸但不可储存液氮 B . 我国 “ 神舟 ” 飞船航天员穿的航天服使用了多种合成纤维 C . 化石燃料的脱硫脱氮、二氧化硫的回收利用和 NO x 的催化转化都是减少酸雨产生的措施 D . 决定化学反应速率的主要因素为反应物自身的性质 |
|
| 4. | 详细信息 |
|
有机物分子中的碳原子与其他原子的结合方式是 A . 通过两个共价键 B . 通过非极性键 C . 形成四对共用电子对 D . 通过离子键和共价键 |
|
| 5. | 详细信息 |
|
下列说法中错误的是 ( ) A . 无论是乙烯与 Br 2 的加成反应,还是乙烯使酸性 KMnO 4 溶液褪色,都与乙烯分子内含有碳碳双键有关 B . 用溴的 CCl 4 溶液或酸性 KMnO 4 溶液都可以鉴别乙烯和乙烷 C . 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 D . 利用燃烧的方法可以鉴别乙烯和甲烷 |
|
| 6. | 详细信息 |
|
下列说法不正确的是 A . 乙酸分子中羧基上的氢原子较乙醇中羟基上的氢原子更活泼 B . 乙醇能与钠反应放出氢气,说明乙醇能电离出 H + 而表现酸性 C . 用金属钠分别与水和乙醇反应,可比较水分子中氢原子和乙醇羟基中氢原子的活泼性 D . 食醋浸泡水垢,可比较乙酸和碳酸的酸性强弱 |
|
| 7. | 详细信息 |
|
下列说法中不正确的是 A . “ 地沟油 ” 禁止食用,但可用来制肥皂 B . 蘸有油脂的器皿可用热氢氧化钠溶液洗 C . 医疗中常用酒精来消毒,是因为酒精能使细菌蛋白质发生变性 D . 糖类、蛋白质、油脂属于天然高分子化合物 |
|
| 8. | 详细信息 |
|
用化学沉淀法去除粗盐中的 Ca 2+ 、 Mg 2+ 、 SO 下列说法 不正确 的是 A . 溶解操作中需用玻璃棒搅拌,其目的是加速粗盐溶解 B . 试剂 1 、试剂 2 、试剂 3 分别可选用 Na 2 CO 3 溶液、 NaOH 溶液、 BaCl 2 溶液 C . 滤液中滴加盐酸直到没有气泡冒出,使滤液呈中性 D . 蒸发结晶时,当蒸发皿中出现较多固体时,停止加热,用余热使滤液蒸干 |
|
| 9. | 详细信息 |
|
下列说法不正确的是 A . 石油裂化的主要产物是乙烯等气态短链烃 B . 废纸、脲醛树脂、旧橡胶制品等均属于有机物 C . 玉米经水解和细菌发酵可以制得乙醇 D . 液氯可以储存在钢瓶中 |
|
| 10. | 详细信息 |
|
佩戴口罩能有效预防新冠疫情扩散。有关口罩的知识,下列说法正确的是 A . 古人使用丝巾遮盖口鼻,丝巾的主要成分是蛋白质 B . 医用口罩过滤层由聚丙烯熔喷布构成,熔喷布是天然高分子材料 C . 一次性防尘口罩可防烟、雾,烟、雾的分散质是空气 D . 氯气泄漏时,可戴上用 NaOH 溶液润湿过的口罩 |
|
| 11. | 详细信息 |
|
一定条件下,硫的某种含氧酸 H 2 SO x (x≤4) 与 H 2 S 可发生反应: H 2 S+H 2 SO x →S+(x-3)SO 2 +H 2 O( 未配平 ) ,下列推断合理的是 A . 该反应中,一定有 SO 2 生成 B . 该反应中, H 2 S 作还原剂, H 2 SO x 作氧化剂 C . 若 x=3 ,则还原剂与氧化剂的物质的量之比为 2 ∶ 1 D . 若 x=4 ,每生成 1molS ,转移的电子的物质的量为 6mol |
|
| 12. | 详细信息 |
|
同学们请游爷爷讲述抗战故事,爷爷打开一个珍藏的箱子,拿出一件粗棉布军装、一把黄铜军号、一副玻璃眼镜和一本记有烈士名单的塑料封皮笔记本,给同学们讲述了当年的惨烈战事。下列说法不正确的是 A . 棉是天然高分子材料 B . 黄铜是合金 C . 玻璃是新型无机非金属材料 D . 塑料是合成高分子材料 |
|
| 13. | 详细信息 |
|
已知: CH 4 +Cl 2 →CH 3 Cl+HCl ,下列有关化学用语表示正确的是 A . CH 4 的球棍模型: B . CH 3 Cl 的电子式: C . Cl - 的结构示意图: D . HCl 在水溶液中的电离方程式: HCl=H + +Cl - |
|
| 14. | 详细信息 |
|
下列关于常见有机物的说法不正确的是 A . 甲烷和乙烯都能与溴水反应 B . 乙酸和油脂都能与氢氧化钠溶液反应 C . 糖类和蛋白质都是人体重要的营养物质 D . 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
|
| 15. | 详细信息 |
|
设 N A 为阿伏加德罗常数的值。下列说法正确的是 A . 2.0g H 2 18 O 与 D 2 O 的混合物中所含中子数为 N A B . 1mol Na 2 O 2 固体中含离子总数为 4N A C . 标准状况下, 11.2 L 酒精中含有分子的数目为 0.5N A D . 1mol Fe 与 1mol Cl 2 充分反应,转移电子数为 3N A |
|
| 16. | 详细信息 |
|
下列离子方程式书写不正确的是 A . Na 与水反应: 2Na + 2H 2 O=2Na + + 2OH - + H 2 ↑ B . 用铜与稀硝酸反应制备一氧化氮: 3Cu+8H + +2NO C . NO 2 通入水中: H 2 O+3NO 2 =2H + +2NO D . FeCl 2 溶液中滴加氨水: Fe 2+ +2OH - =Fe(OH) 2 ↓ |
|
| 17. | 详细信息 |
|
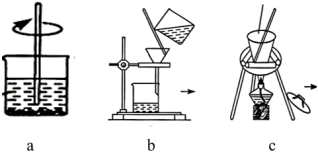
实验室某硝酸钾固体样品中混有少量硫酸铵和碳酸钾杂质,现需除去杂质,得到纯净的硝酸钠固体。某化学兴趣小组设计实验方案并采取如下实验装置: 固体样品 下列说法不合理的是 A . 试剂 ①为蒸馏水,试剂②为 Ba(OH) 2 溶液,试剂 ③为稀 HNO 3 B . 操作 ①为溶解,采用装置 a ;操作 ②为过滤,采用装置 b ;操作 ③为结晶,采用装置 c C . 装置 a 用玻璃棒可以加快该步骤的速度,装置 b 用玻璃棒来引流 D . 操作 ③可以为蒸发结晶,也可以为蒸发浓缩、冷却结晶、过滤 |
|
| 18. | 详细信息 |
|
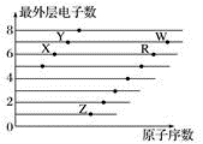
如图是部分短周期元素原子 ( 用字母表示 ) 最外层电子数与原子序数的关系图。下列说法不正确的是( ) A . 氢化物沸点: H 2 X > H 2 R B . 含氧酸酸性: HWO > H 2 RO 4 C . 气态氢化物的稳定性: HY > HW > H 2 R D . 离子半径: R 2- > X 2- > Y - > Z + |
|
| 19. | 详细信息 |
|
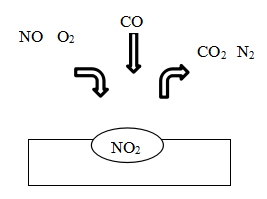
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示: 下列说法 不正确 的是 A . 该转化过程中有 3 种元素的化合价发生变化 B . NO 和 O 2 必须在催化剂表面才能反应 C . 该装置将有毒的 NO 和 CO 转化为无毒的 CO 2 和 N 2 D . 该催化转化的总反应方程式为: 2NO+O 2 +4CO |
|
| 20. | 详细信息 |
|
从某些性质看 (CN) 2 和 Cl 2 , NH 3 和 H 2 O , NH A . (CN) 2 +2OH - =CO+N 2 +H 2 O B . 2Na+2NH 3 =2NaNH 2 +H 2 ↑ C . CuO+2NH 4 Cl=CuCl 2 +2NH 3 +H 2 O D . NH 4 Cl+NaNH 2 =2NH 3 ↑+NaCl |
|
| 21. | 详细信息 |
|
由反应 3Cl 2 + 2Fe(OH) 3 + 10KOH=2K 2 FeO 4 + 6KCl + 8H 2 O 制得水处理剂 K 2 FeO 4 。下列说法错误的是 A . Cl 2 作氧化剂, Fe(OH) 3 在反应中失去电子 B . 每消耗 1mol 还原剂转移电子的物质的量为 3mol C . 氧化剂与氧化产物的物质的量之比为 1 : 2 D . 应用 K 2 FeO 4 处理水,即可杀菌又可除悬浮杂质 |
|
| 22. | 详细信息 |
|
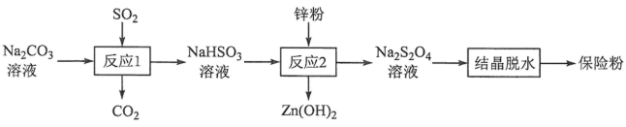
连二亚硫酸钠 (Na 2 S 2 O 4 ) 俗称保险粉,有强还原性,在空气中极易被氧化。用 NaHSO 3 还原法制备保险粉的流程如下: 下列说法错误的是 A . 反应 1 说明酸性: H 2 SO 3 >H 2 CO 3 B . 反应 1 结束后,可用盐酸酸化的 BaCl 2 溶液检验 NaHSO 3 是否被氧化 C . 反应 2 中消耗的氧化剂和还原剂的物质的量之比为 1 ∶ 2 D . 反应 2 最好在无氧条件下进行 |
|
| 23. | 详细信息 |
|
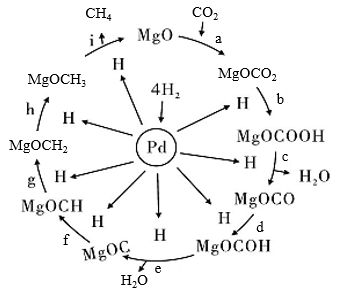
在 Pd-Mg/SiO 2 催化下利用 Sabatierf 反应可实现 CO 2 “甲烷化”,其反应机理如图所示。下列说法错误的是 A . 整个变化过程所有反应既有氧化还原反应,又有非氧化还原反应 B . 反应 a 中, MgO→MgOCO 2 只有共价键的断裂与形成 C . 总反应可表示为: CO 2 +4H 2 D . 反应过程中 Pd 的作用是使 H—H 断裂活化 |
|
| 24. | 详细信息 |
|
下列检验试样的操作正确的是 A . 检验 SO 2 :通入 BaCl 2 溶液中 B . 检验 C . 检验 NH 3 :用蘸有浓硫酸的玻璃棒靠近打开的瓶口 D . 检验 |
|
| 25. | 详细信息 |
|
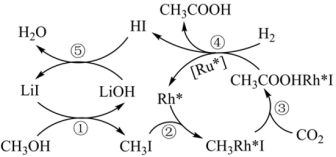
在 Ru-Rh( 钌铑 ) 基催化剂表面发生反应制备乙酸的一种机理如图,下列说法正确的是 A . 该过程中反应 ①⑤的反应类型相同 B . 反应 ③中既有非极性键的断裂,又有非极性键的形成 C . 制取乙酸的总方程式为: CO 2 +H 2 +CH 3 OH D . LiI 也是该反应的催化剂 |
|
| 26. | 详细信息 |
|
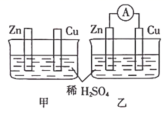
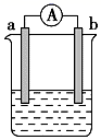
分别按如图甲、乙所示装置进行实验图中两个烧杯里的溶液为同浓度的稀硫酸,乙中 A . 甲中锌片是负极,乙中铜片是正极 B . 两烧杯中铜片表面均有气泡产生 C . 乙的外电路中电子方向为 Zn→Cu D . 两烧杯中锌片均被氧化,生成 Zn 2+ |
|
| 27. | 详细信息 | |||||||||||||||
|
由下列实验操作及现象所得的结论错误的是
A . A B . B C . C D . D |
||||||||||||||||
| 28. | 详细信息 |
|
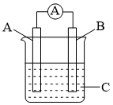
2020 年,美国路易斯华盛顿大学教授课题组将导电高分子 (PEDOT) 与普通红砖结合,研发出了一种可存储电能的超级电容器电极。未来可能某一面墙的某块区域可作为充电模块,直接为接入其中的手机、电能等电子产品供电。下图所示装置也可以给用电器供电,工作时 A 极的质量减小, B 极上有气泡产生, C 为电解质溶液,下列分析正确的是 A . A 极为此供电装置的正极 B . A 、 B 、 C 分别可以为 Zn 、 Cu 和稀硫酸 C . C 中阳离子向 A 极移动 D . B 极发生还原反应 |
|
| 29. | 详细信息 | ||||||||||||||||||||
|
I . H 2 (g) 和 CH 3 OH(l) 的燃烧热分别为 285.8 Ⅱ .如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: (1) 当电极 a 为 Al ,电极 b 为 Cu ,电解质溶液为稀硫酸时,正极的电极反应式为 ___________ , H + 移向 ___________ 极 ( 填 “a” 或 “b”) 。 (2) 利用反应 “Cu+2Ag + =2Ag+Cu 2+ ” 设计一个化学电池,该电池的电解质溶液是 ___________ 。 Ⅲ. 在温度不变的条件下,密闭容器中发生如下反应 2SO 2 (g)+O 2 (g) (1) 温度恒容条件下, O 2 的浓度在 2min 内由 0.4mol/L 变成了 0.1mol/L ,则由 SO 2 表示的这段时间内反应的平均速率为 ___________ mol/(L·min) ; (2) 若压缩气体体积以增大压强,该反应的反应速率将 ___________ ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”) 。 Ⅳ. 在 1.0L 密闭容器中放入 0.10molA(g) ,在一定温度进行如下反应: A(g)
回答下列问题: (1) 判断正误:第 25 分钟时反应体系处于化学平衡状态 ___________ 。 ( 填 “ 对 ” 或 “ 错 ”) (2) 由总压强 P 和起始压强 P 0 计算反应物 A 的平衡转化率 α(A)= ___________ ( 保留一位小数 ) 。 |
|||||||||||||||||||||
| 30. | 详细信息 |
|
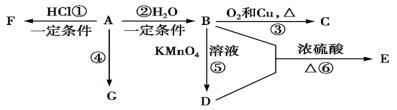
A 、 B 、 C 、 W 均为中学常见的物质,它们之间有如下转化关系 ( 其他产物及反应条件已略去,反应可以在水溶液中进行 ) 。 (1) 若 B 的溶液显黄色,一定条件下 B 的饱和溶液可与沸水反应生成红褐色胶体。 ①区分 B 溶液和该红褐色胶体的方法是 ___________ ; ②往 C 溶液中加入氢氧化钠溶液的现象为 ___________ ; (2) 若 A 是一种使湿润的红色石蕊试纸变蓝的气体, C 是一种红棕色的气体: ① A 与盐酸反应所得产物为 ___________ ( 填 “离子化合物”或“共价化合物” ) ; ②写出 A 的一种用途 ___________ ; (3) 若 A 、 B 、 C 三种物质的溶液均显碱性,焰色反应均为黄色, C 受热分解可转化为 B 。 ① B 的俗名为 ___________ ; ② A 与过量 W 转化为 C 的总反应的离子方程式为 ___________ ; (4) 若 B 是一种黄色单质, C 能杀菌消毒、漂白并是一种食品添加剂: ① A 的结构式为 ___________ ; ② C 和 A 反应的化学反应方程式为 ___________ |
|
| 31. | 详细信息 |
|
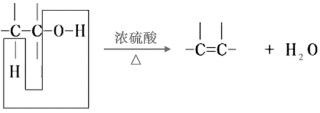
已知醇类能在浓硫酸作用下加热发生反应: 有机物 B 是相对分子质量为 28 的气态烃,能使溴水褪色。 E 是具有香味的液体。有关物质的转化关系如图: (1)B 分子的名称是 _______ 。 F 的结构式为 _______ 。 (2)A→F 的反应类型为 _______ ; A→C 的化学方程式为 _______ 。 (3) 下列说法正确的是 _______ 。 a. 可用紫色石蕊试液鉴别 A 和 D b. 有机物 A 和 D 都能与 Na 2 CO 3 反应 c. 等物质的量的 A 和 B 完全燃烧时消耗等量氧气 (4) 物质 G 在一定条件下生成的高分子化合物的结构简式是 _______ 。 (5) 物质 D 与 A 发生反应生成 E 的化学方程式为 _______ 。 |
|
| 32. | 详细信息 |
|
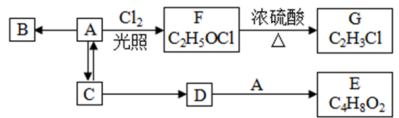
已知: A 是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物 A ~ G 之间的转化关系: 请回答下列问题: (1)A 中所含官能团的名称是 ___________ ; C 的结构简式是 ___________ 。 (2)E 是一种具有香味的液体,由 B + D→E 的反应方程式为 ___________ ,反应类型是 ___________ 。 (3)G 是一种高分子化合物,其结构简式是 ___________ 。 (4) 比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质 F 进行应急处理。写出由 A 制 F 的化学反应方程式: ___________ 。 (5)H 是 E 的同分异构体,且 H 能与 NaHCO 3 反应,则 H 的结构简式可能为 ( 写出 1 种 ) : ___________ 。 |
|
| 33. | 详细信息 |
|
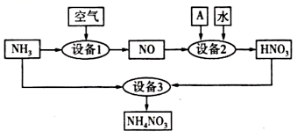
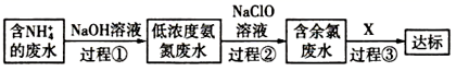
研究氮的循环和转化对生产、生活有重要的价值。 I .( 1 )写出实验室制备氨气的化学方程式 _______ 。 II .氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下所示。 ( 2 )设备 1 、 3 中发生反应的化学方程式分别是 ____ 、 _____ 。设备 2 中通入的物质 A 是 ____ 。 III .氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 ( 3 )过程①的目的是将 ( 4 )过程②加入 NaClO 溶液可将氨氮转化为无毒物质,反应后含氮元素的物质化学式为 ____ 。 ( 5 )含余氯废水的主要成分是 NaClO 以及 HC1O 。 X 可选用以下哪种溶液以达到去除余氯的目的 ____ (填序号)。 a . KOH b . Na 2 SO 3 c . KMnO 4 d . NaCl |
|
| 34. | 详细信息 |
|
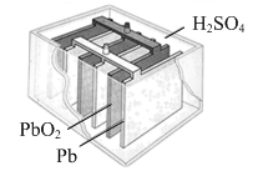
碳、硅、锗、锡、铅属于同一主族元素,其单质及化合物具有重要的用途。 (1) 铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为 PbO 2 +Pb+4H + +2 (2)PbO 2 可发生如图所示的转化: ①写出 “ 还原 ” 反应的离子方程式: __________ ; ②写出 “ 复分解 ” 反应的化学方程式: ___________ 。 (3)1400 ℃~ 1450 ℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物 X ,该反应的化学方程式为 3SiO 2 +6C+2N 2 ① X 的化学式为 _______ 。 ②下列措施 不 能提高该反应速率的是 _______ ( 填字母 ) 。 a. 将石英和焦炭充分混合 b. 增大 N 2 的浓度 c. 将粉末状石英换成块状石英 (4) 甲醇是常见的燃料电池原料, CO 2 催化氢化可合成甲醇: CO 2 (g)+3H 2 (g) ⇌ CH 3 OH(g)+H 2 O(g) ΔH < 0 。在 2L 容器中充入 1molCO 2 和 3moH 2 的混合气体,反应 10min 后,气体的总物质的量变为原来的 75% 。则 0 ~ 10min 内, H 2 的平均反应速率为 _______ 。 |
|
| 35. | 详细信息 |
|
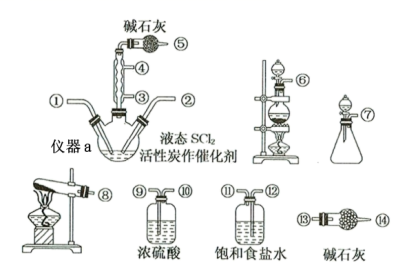
氯化亚砜( SOCl 2 )是一种液态化合物,沸点为 77 ℃,在农药、制药行业中用途广泛。 SOCl 2 遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理: SO 2 +Cl 2 +SCl 2 =2SOCl 2 ,部分装置如图所示,回答以下问题: (1) 仪器 a 的名称为 _______ 。 (2) 实验室制取 SOCl 2 在仪器 a 中合成,整个装置所选仪器的连接顺序是: ⑥ → ⑫ → ⑪ → ⑨ → ⑩ → ①② ← _______ ( 用 “←” 连接各接口,箭头表示气体流向,装置可重复使用 ) 。 (3) 冷凝管上连接的干燥管的作用是 _______ 。 (4) 该实验制取氯气的离子方程式为 _______ 。 (5) SOCl 2 与水反应的化学方程式为 _______ 。 (6) 若反应中消耗的 Cl 2 的体积为 896mL ( 已转化为标准状况, SO 2 足量 ) ,最后得到纯净的 SOCl 2 6.76g ,则 SOCl 2 的产率为 _______ ( 保留二位有效数字 ) |
|
| 36. | 详细信息 |
|
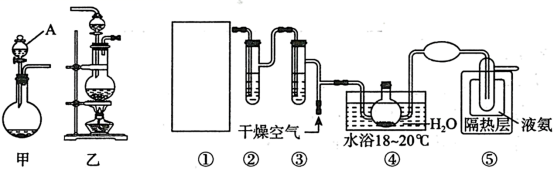
Cl 2 O 又称为次氯酸酐,是强氧化剂,易溶于水且与水反应,受热时容易燃烧、高浓度时容易爆炸。其熔沸点分别为 -116 ℃和 3.8 ℃; Cl 2 的沸点是 -34.6 ℃。现利用 HgO 和 Cl 2 以及以下装置制备 Cl 2 O : 回答下列问题: (1) 仪器 A 的名称: ___________ 。用酸性高锰酸钾制备 Cl 2 应采用气体发生装置: ___________ ( 填 “甲”或“乙” ) (2) ②、③中盛放的试剂分别是 ___________ 、 ___________ 。 (3) 写出 HgO 和 Cl 2 制备 Cl 2 O 的化学方程式: ___________ 。 (4) 通入干燥空气的目的是 ___________ 。 (5) 实验装置存在一些不足,请指出 ___________ 。 (6) 要想进一步分离得到 Cl 2 O ,采用的操作方法是: ___________ 。 |
|