2017辽宁高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列对生活中某些物质的认识错误的是 A. 酒精可用于杀菌消毒 B. 液化石油气的主要成分属于烃类 C. 塑料、油脂、橡胶均属于高分子化合物 D. 普通肥皂的主要成分是高级脂肪酸的钠盐
|
|
| 2. | 详细信息 |
|
下列对化学变化的认识错误的是 A. 会引起化学键的变化 B. 会产生新的物质 C. 必然伴随着能量的变化 D. 必然引起物质状态的变化
|
|
| 3. | 详细信息 |
|
下列有关化学用语的表达正确的是 A. NH4Cl的电子式: C. 含92个质子、143个中子的铀原子:
|
|
| 4. | 详细信息 |
|
有机物C3H6Cl2的同分异构体有(不考虑立体异构) A. 2种 B. 3种 C. 4种 D. 5种
|
|
| 5. | 详细信息 |
|
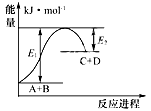
反应A+B=C+D的能量变化如图所示,下列说法正确的是
A. 该反应为放热反应 B. 该反应吸收的能量为(E1-E2) C. 反应物A的能量低于生成物C的能量 D. 该反应只有在加热条件下才能进行
|
|
| 6. | 详细信息 |
|
下列关于化学键的叙述正确的是 A. 离子化合物中一定含有离子键 B. 单质分子中均存在化学键 C. 离子化合物中只有离子键 D. 含有共价键的化合物一定是共价化合物
|
|
| 7. | 详细信息 |
|
下列说法正确的是 A. 糖类、油脂、蛋白质都能发生水解反应 B. 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 C. 纤维素、淀粉的化学式都可用(C6H10O5)n表示,它们互为同分异构体 D. 木材纤维和土豆淀粉遇碘水均显蓝色
|
|
| 8. | 详细信息 |
|
下列各组中的物质均能发生加成反应的是 A. 甲烷和乙醇 B. 丙烯和丙烷 C. 乙酸和乙酸乙酯 D. 苯和乙烯
|
|
| 9. | 详细信息 |
|
下列有关海水综合利用的说法正确的是 A. 海水中含有钾元素,只需经过物理变化就可以得到钾单质 B. 海水蒸发制海盐的过程中只发生了化学变化 C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na和Cl2 D. 利用潮汐发电是将化学能转化为电能
|
|
| 10. | 详细信息 |
|
能证明乙烯分子里含有一个碳碳双键的事实是 A. 乙烯分子里碳氢原子个数比为1∶2 B. 乙烯能使酸性高锰酸钾溶液褪色 C. 1 mol乙烯完全加成消耗1 mol溴单质 D. 乙烯完全燃烧生成的CO2和H2O的物质的量相等
|
|
| 11. | 详细信息 |
|
如图所示的原电池装置,下列判断正确的是
A. 外电路的电流方向为:X→导线→Y B. 若两电极都是金属,则它们的活动性顺序为X<Y C. X极上发生的是还原反应,Y极上发生的是氧化反应 D. 放电一段时间后,烧杯中溶液的酸性减弱
|
|
| 12. | 详细信息 |
|
下列关于苯的说法中正确的是 A. 苯分子中6个碳原子之间的化学键完全相同 B. 苯分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色 C. 在催化剂存在下,苯能与溴水发生取代反应,生成溴苯 D. 苯是一种密度比水大,不溶于水的有特殊气味的无色液体
|
|
| 13. | 详细信息 | |||||||||||||||
|
下列除去括号内杂质的有关操作方法正确的是
A. A B. B C. C D. D
|
||||||||||||||||
| 14. | 详细信息 |
|
下列化学反应在冶金工业中没有得到广泛应用的是 A. MgCl2(熔融) C. Fe2O3+3CO
|
|
| 15. | 详细信息 |
|
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中,同时存在极性键和非极性键的是 A. Z2Y B. Z2Y2 C. X2Y2 D. ZYX
|
|
| 16. | 详细信息 |
|
可逆反应A(g)+4B(g) A. v(A)=0.2 mol/(L·min) B. v(B)=0.6 mol/(L·min) C. v(C)=0.5 mol/(L·min) D. v(D)=0.01 mol/(L·s)
|
|
| 17. | 详细信息 |
|
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是 A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
|
|
| 18. | 详细信息 |
|
下列有关煤、石油、天然气的说法中错误的是 A. 石油裂解可以得到汽油,这种汽油是一种混合物 B. 煤的气化是将其转化为可燃性气体的过程 C. 天然气是一种清洁的化石燃料 D. 煤的干馏可以得到甲烷、苯和氨等重要化工原料
|
|
| 19. | 详细信息 |
|
“绿色化学”对化学反应提出了“原子经济性”(原子利用率100%)的概念及要求。以下反应中符合“绿色化学”的是 A. 乙烯与氧气在银的催化作用下生成环氧乙烷( B. 利用乙烷与氯气反应,制备氯乙烷 C. 以苯、浓硝酸和浓硫酸为原料,制备硝基苯 D. Cu与浓硫酸反应制备CuSO4
|
|
| 20. | 详细信息 |
|
氢气在氯气中燃烧产生苍白色火焰,在反应中破坏1 mol氢气中的化学键吸收的能量为a kJ,破坏1 mol 氯气中的化学键吸收的能量为b kJ,形成1 mol氯化氢中的化学键释放的能量为c kJ。下列关系式中正确的是 A. a+b=2c B. a+b>2c C. a+b<c D. a+b<2c
|
|
| 21. | 详细信息 |
|
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小的顺序排列正确的是 甲.在500℃时,SO2和O2各10 mol反应 乙.在500℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应 丙.在450℃时,8 mol SO2和5 mol O2反应 丁.在500℃时,8 mol SO2和5 mol O2反应 A. 甲、乙、丙、丁 B. 乙、甲、丙、丁 C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
|
|
| 22. | 详细信息 |
|
在一定条件下,可逆反应X(g)+3Y(g) A. X、Y的浓度不再变化 B. 单位时间生成a mol X,同时生成3a mol Y C. X、Y、Z的分子数之比为1∶3∶2 D. X占混合气体的体积分数不变
|
|
| 23. | 详细信息 |
|
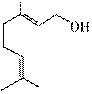
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示。下列有关香叶醇的叙述正确的是
A. 香叶醇的分子式为C10H18O B. 不能使溴的四氯化碳溶液褪色 C. 不能使酸性高锰酸钾溶液褪色 D. 能发生加成反应不能发生取代反应
|
|
| 24. | 详细信息 |
|
X、Y、Z、W为四种短周期元素,它们在周期表中的位置关系如图所示。Z元素的最外层电子数等于其电子层数。下列说法中正确的是
A. Y的气态氢化物比X的氢化物沸点低 B. Z元素的氧化物属于碱性氧化物 C. 原子半径由小到大的顺序为:X<Z<Y<W D. Y元素最高价氧化物对应的水化物化学式为H3YO4
|
|
| 25. | 详细信息 |
|
下列有机物分子中,所有原子一定在同一平面的是 A. CH3CH3 B. CH2=CH2 C.
|
|
| 26. | 详细信息 |
|
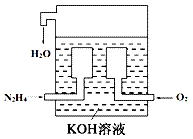
(1)燃料电池已广泛应用于航空领域。如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的_______(填“正极”或“负极”),该电极的电极反应式为_________________。放电过程中,溶液中的阳离子移向_______(填“正极”或“负极”)。
(2)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为________ mol,消耗氧气的体积为________ L(标准状况)。 (3)与传统火力发电相比,燃料电池的优点是_________、________。
|
|
| 27. | 详细信息 |
|
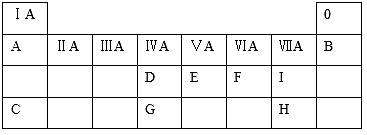
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
(1)D的氢化物比G的氢化物________________(填“稳定”或者“不稳定”)。 (2)A与E可形成一种极易溶于水的气态化合物,该化合物溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。 (3)C、H、I简单离子的半径由大到小的顺序是________________(用离子符号表示)。 (4)由C和F组成的一种化合物可用作核潜艇中氧气的来源,写出该化合物的电子式:________________________。
|
|
| 28. | 详细信息 |
|
在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) (1)5 min末A的物质的量浓度为______________。 (2)前5 min内用B表示的化学反应速率v(B)为______________。 (3)化学方程式中n值为______________。 (4)平衡时B的转化率为______________。 (5)反应开始时与达到平衡后容器中压强之比为______________。
|
|
| 29. | 详细信息 |
|
已知:①A的产量通常用来衡量一个国家的石油化工水平; ②2CH3CHO+O2 现以A为主要原料合成乙酸乙酯,其合成路线如下图所示:
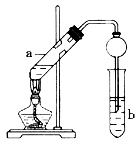
回答下列问题: (1)写出C的结构简式____________。 (2)B、D分子中的官能团名称分别是________、________。 (3)写出A→B的反应类型:__________________。 (4)1 mol A与氯气发生完全加成反应,所得产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是____________ mol。 (5)实验室利用上述原理制取CH3COOCH2CH3,可用下图装置:
①a试管中的主要化学反应的方程式为_______________________________。 ②球形干燥管的作用_______________________、________________________。 ③试管b中盛放的是_________________溶液。
|
|
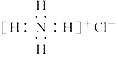 B.
B. 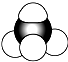


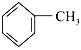 D. CH3COOH
D. CH3COOH