2016北京九年级下学期人教版初中化学开学考试
| 1. | 详细信息 |
|
下列属于化学变化的是( ) A.铁生锈 B.石蜡熔化 C.酒精挥发 D.冰雪融化
|
|
| 2. | 详细信息 |
|
物质的下列性质,属于化学性质的是( ) A.颜色、状态 B.密度、硬度 C.氧化性、可燃性 D.熔点、沸点
|
|
| 3. | 详细信息 |
|
空气中含量较多且性质不活泼的气体是( ) A.氧气 B.氮气 C.二氧化碳 D.水蒸气
|
|
| 4. | 详细信息 |
|
地壳中含量最多的元素是( ) A.铝 B.铁 C.硅 D.氧
|
|
| 5. | 详细信息 |
|
下列图标中,表示“禁止烟火”的是( ) A.
|
|
| 6. | 详细信息 |
|
下列物质中,属于纯净物的是( ) A.洁净的空气 B.汽水 C.液态氧 D.水泥砂浆
|
|
| 7. | 详细信息 |
|
造成酸雨的主要物质是( ) A.甲烷和一氧化碳 B.二氧化硫和一氧化碳 C.一氧化碳和二氧化碳 D.二氧化硫和二氧化氮
|
|
| 8. | 详细信息 |
|
下列关于氧气性质的描述、错误的是( ) A.在通常状况下,氧气是一种无色、无味的气体 B.氧气在低温高压时变为液体或固体 C.氧气极易溶于水 D.氧气是一种化学性质比较活泼的气体
|
|
| 9. | 详细信息 |
|
引起煤气中毒的物质是( ) A.一氧化碳 B.甲烷 C.二氧化碳 D.二氧化硫
|
|
| 10. | 详细信息 |
|
与元素的化学性质关系最密切的是( ) A.元素的相对原子质量 B.元素的核电荷数 C.原子的核外电子数 D.原子的最外层电子数
|
|
| 11. | 详细信息 |
|
原子核是( ) A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.由质子、中子、和电子构成
|
|
| 12. | 详细信息 |
|
从环境保护的角度考虑,下列燃料最理想的是( ) A.氢气 B.天然气 C.酒精 D.汽油
|
|
| 13. | 详细信息 |
|
下列气体与空气混合后遇明火,可能发生爆炸的是( ) A.氧气 B.氮气 C.一氧化碳 D.二氧化碳
|
|
| 14. | 详细信息 |
|
下列实验操作正确的是( ) A.
|
|
| 15. | 详细信息 |
|
某工地发生多人食物中毒的事故,经化验是由于误食亚硝酸钠(化学式为NaNO2)所致.亚硝酸钠中氮元素的化合价为( ) A.+2价 B.+3价 C.+4价 D.+5价
|
|
| 16. | 详细信息 |
|
下列说法中不正确的是( ) A.在过氧化氢溶液的分解反应中,二氧化锰起催化作用 B.氧气的化学性质很活泼,在常温下能与所有物质发生化学反应 C.细铁丝在氧气里燃烧,火星四射,生成黑色固体 D.用排水法可以收集不易溶于水的气体
|
|
| 17. | 详细信息 |
|
实验室制取氧气的实验中,不需要使用的一组仪器是( ) A.烧杯 玻璃棒 B.大试管 集气瓶 C.酒精灯 铁架台 D.导管 单孔塞
|
|
| 18. | 详细信息 |
|
下列净化水的方法中,净化程度最高的是( ) A.蒸馏 B.吸附 C.沉淀 D.过滤
|
|
| 19. | 详细信息 |
|
下列说法正确的是( ) A.氯化氢是由氢、氯两种元素组成的 B.氯化氢是由氢气和氯气混合而成的 C.氯化氢是由一个氢原子和一个氯原子构成的 D.一个氯化氢分子是由两个氢元素和一个氧元素组成的
|
|
| 20. | 详细信息 |
|
碳的相对原子质量是( ) A.12克 B.12 C.1.993×10﹣26 kg D.
|
|
| 21. | 详细信息 |
|
下列有关催化剂的说法正确的是( ) A.在化学反应后其质量减小 B.在化学反应后其质量增加 C.催化剂能改变化学反应速率 D.在化学反应后其化学性质发生了改变
|
|
| 22. | 详细信息 |
|
根据化学方程式不能获得的信息是( ) A.该反应中的反应物和生成物 B.各反应物和生成物的质量比 C.反应发生所需的条件 D.化学反应的快慢
|
|
| 23. | 详细信息 |
|
现将10g A和足量B混合加热,A和B发生化学反应,10g A完全反应后生成8g C和4g D,则参加反应的A和B的质量比是( ) A.1:1 B.2:1 C.4:1 D.5:1
|
|
| 24. | 详细信息 |
|
植物的光合作用可表示为:二氧化碳+水→淀粉+氧气.根据以上信息,下列关于淀粉组成的说法正确的是( ) A.只含有碳、氢元素 B.含有碳、氧、氢三种元素 C.含有碳、氢元素,可能含有氧元素 D.无法确定
|
|
| 25. | 详细信息 |
|
化学反应前后肯定没有变化的是( ) ①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量. A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
|
|
| 26. | 详细信息 |
|
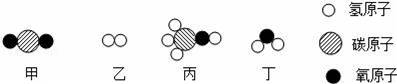
甲和乙在一定条件下反应生成丙和丁.结合微观示意图分析,下列结论正确的是( )
A.丙的相对分子质量为24 B.生成的丙和丁的分子个数比为2:1 C.反应前后分子总数不变 D.发生反应的甲和乙的质量比为22:3
|
|
| 27. | 详细信息 |
|
一种淡蓝色固体物质受热后变成气体,颜色变浅,这种变化( ) A.一定是物理变化 B.一定是化学变化 C.可能是物理变化,也可能是化学变化 D.既不是物理变化,也不是化学变化
|
|
| 28. | 详细信息 |
|
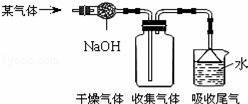
图是收集某气体的装置.由实验装置推测该气体的有关说法正确的是( )
A.该气体的密度比空气的密度小 B.该气体能与NaOH发生反应 C.该气体极易溶于水 D.该气体可能是O2
|
|
| 29. | 详细信息 |
|
金属钠的相关信息如下:①银白色的金属; ②密度比水小,比煤油大; ③钠很软,可以用刀切开;④常温下,钠与氧气、硫、水等均能快速反应; ⑤钠在高温高压时甚至可以和氢气发生反应生成氢化钠(NaH).根据上述信息,下列说法正确的是( ) A.描述金属钠的物理性质有①②⑤ B.描述金属钠的化学性质有③④ C.⑤中反应的化学方程式为2Na+H2=2NaH D.金属钠存放于煤油中的原因之一是钠比煤油密度大
|
|
| 30. | 详细信息 |
|
如图是装有锂(Li)电池的儿童遥控汽车.锂电池放电时发生的化学反应为:Li+MnO2═LiMnO2,计算3.5gLi参加反应所消耗的MnO2的质量.
|
|
| 31. | 详细信息 |
|
2N2表示( ) A.4个氮原子 B.2个氮分子 C.4个氮分子 D.2个氮原子
|
|
| 32. | 详细信息 |
|
根据下列物质的性质,写出其对应的一种或几种用途: (1)金刚石的硬度很大: ; (2)石墨的导电性能好: ; (3)活性炭的吸附性强: ; (4)一氧化碳碳具有还原性: ; (5)常温下,碳的化学性质不活泼: .
|
|
| 33. | 详细信息 |
|
选择氧气、一氧化碳或二氧化碳填空,并写出有关的化学方程式. (1)能使带火星的木条复燃的是 (填化学式,下同). (2)能使澄清的石灰水变浑浊的是 ,反应的化学方程式是 (3)能使氧化铜还原成铜的是 ,反应的化学方程式是
|
|
| 34. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
阅读下面科普短文 世界万物是由什么形成的?这是人类自古以来就不断探索的问题.利用化学方法分析众多的物质,发现组成他们的基本成分一一元素其实有一百多种.下面介绍其中一种重要的元素钠元素. 钠是一种活泼金属,其原子的结构示意图为为 属钠. 金属钠的应用非常广泛,可以用于制造过氧化钠(Na2O2)等化合物.还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来. 依据文章内容,回答下列问题: (1)钠具有的物理性质有 . (2)金属钠通常保存在石蜡油中,目的是隔绝 . (3)钠能与水反应的化学方程式是 2 . (4)用钠制取钾的化学方程式是 . (5)请写出质子数1﹣20号元素的名称及符号.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 35. | 详细信息 | ||||||
|
建立宏观、微观和符号之间的联系有重要意义. (1)如图物质是由不同粒子构成的,请用化学符号表示出构成这些物质的粒子.
(2)N(NO2)3是科学家2011年发现的一种新型火箭燃料.计算N(NO2)3的相对分子质量为 ,N(NO2)3中氮元素和氧元素的质量比为 (结果用最简整数比表示),N(NO2)3中氮元素的质量分数为 (最终结果保留一位小数).
|
|||||||
| 36. | 详细信息 | ||||||||||||||||
|
化学元素可以组成许多化学物质,在表中填写对应物质的化学式.
|
|||||||||||||||||
| 37. | 详细信息 |
|
根据如图回答问题.
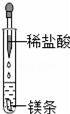
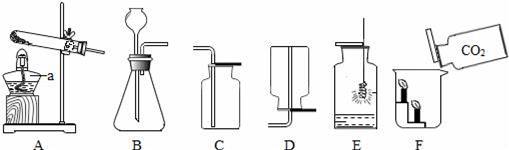
(1)仪器a的名称是 . (2)实验室用高锰酸钾制取氧气的化学方程式是 ,选用的收集装置是 (填序号,下同).如图E所示,铁丝与氧气反应的化学方程式是 . (3)实验室用大理石和稀盐酸制取二氧化碳选用的发生装置是 .如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是 .
|
|
| 38. | 详细信息 |
|
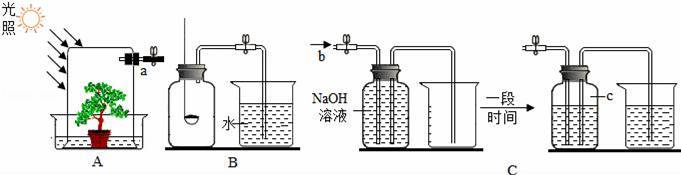
某课外小组的同学将玻璃罩内充满纯净的二氧化碳气体,如图A所示,在光照充足的条件下,经过一段时间后.该小组同学用注射器从a处抽取气体,测定玻璃罩内气体的成分及其含量.
【查阅资料】 ①植物通过光合作用吸收二氧化碳气体,放出氧气. ②二氧化碳能溶于水,1L水大约能溶解1L二氧化碳气体. ③氢氧化钠和氢氧化钙性质相似,其水溶液都能与二氧化碳发生反应.其中氢氧化钠与二氧化碳反应生成水和碳酸钠,且碳酸钠易溶于水. 【方案设计及实验】采用两种方法测定玻璃罩内气体中氧气的含量. 方法1:用如图B所示的装置测量气体中氧气的含量. (1)将抽取出的气体用排水法收集到150mL的集气瓶中,在集气瓶外点燃红磷,将点燃的红磷迅速伸入集气瓶中,并塞紧瓶塞.此时反应的化学方程式为 . (2)待装置冷却到室温后,打开止水夹,烧杯中的液体进入集气瓶中,体积约为125mL. 方法2:用如图C所示的装置测量气体中氧气的含量. (1)抽取150mL的气体,缓缓地从b处通入装置中.此时集气瓶中发生反应的化学方程式为 . (2)实验结束后,c处气体的化学式为 ,集气瓶中排出液体的体积约为75mL. 【实验反思】 通过对比,该小组同学发现,两种方法所得实验结果差距较大,其中实验结果更准确的是 (填写“方法1”或“方法2”),该方法所测得氧气约占气体总体积的 %.
|
|

 B.
B.
 C.
C.
 D.
D.

 B.
B.
 C.
C.
 D.
D.