2018浙江高一下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列属于碱的是 ( ) A. H2SO4 B. KClO3 C. Ca(OH)2 D. CO2
|
|
| 2. | 详细信息 |
|
下列仪器称为“干燥管”的是( ) A.
|
|
| 3. | 详细信息 |
|
下列物质中,属于非电解质,但溶于水后所得溶液导电性明显增强的是( ) A. 金属钠 B. 乙醇 C. 硝酸钾 D. 三氧化硫
|
|
| 4. | 详细信息 |
|
研究结果表明,太阳气体中存在大量的20Ne和22Ne。下列关于20Ne和22Ne的说法正确的是 ( ) A. 22Ne的原子核中有22个中子 B. 20Ne和22Ne是同一种核素 C. 20Ne的原子核中有20个质子 D. 20Ne和22Ne互为同位素
|
|
| 5. | 详细信息 |
|
下列属于氧化还原反应,且为吸热反应的是 ( ) A. C+H2O C. Zn+2H+=Zn2++H2↑ D. CaCO3
|
|
| 6. | 详细信息 |
|
下列哪个是该 A. 3,6-二甲基-4-乙基庚烷 B. 2,5-二甲基-4-乙基庚烷 C. 2,2-二甲基庚烷 D. 2,5-甲基-4-乙基庚烷
|
|
| 7. | 详细信息 |
|
下列说法不正确的是 ( ) A. 工业制取硫酸过程中生成的SO2可循环利用 B. 钢铁因含杂质而容易生锈 C. 沙子、石英、水晶、硅藻土都是天然存在 D. 在医疗上硫酸亚铁可用作生产防治缺铁性贫血的药剂
|
|
| 8. | 详细信息 |
|
已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是 A. N2H4+O2=N2+2H2O △H=-534.4kJ/mol B. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ/mol C. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= +534.4kJ/mol D.
|
|
| 9. | 详细信息 |
|
.以下化学用语正确的是 ( ) A. 乙烯的结构简式CH2CH2 B. 乙烷的分子式C2H6 C. 甲烷的空间结构是平面 D. 氯化钠的电子式
|
|
| 10. | 详细信息 |
|
HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是 ( ) A. HgCl2属于离子化合物 B. HgCl2属于共价化合物 C. HgCl2属于非电解质 D. HgCl2中既存在离子键也存在共价键
|
|
| 11. | 详细信息 |
|
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是 A. a与其他三种元素形成的二元化合物中其化合价均为+1 B. b与其他三种元素均可形成至少两种二元化合物 C. c的原子半径是这些元素中最大的 D. d和a形成的化合物的溶液呈弱酸性
|
|
| 12. | 详细信息 |
|
下列有关能量转换的说法不正确的是( ) A. 煤燃烧是化学能转化为热能的过程 B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程
|
|
| 13. | 详细信息 | |||||||||||||||
|
下列由实验得出的结论正确的是( )
A. A B. B C. C D. D
|
||||||||||||||||
| 14. | 详细信息 |
|
加成反应是有机化学中的一类重要的反应,下列过程中发生加成反应的是 ( ) A. 甲烷与氯气混合后光照条件下发生反应 B. 在苯中滴入溴水,振荡后溴水层颜色变浅 C. 乙烯通入酸性高锰酸钾溶液后溶液褪色 D. 乙烯通入溴的四氯化碳溶液发生反应
|
|
| 15. | 详细信息 |
|
下列说法正确的是 ( ) A. “碳纳米泡沫”被称为第五形态的单质碳,它与石墨互为同素异形体 B. 分子组成相差一个或若干个CH2原子团的物质,彼此一定互为同系物 C. 宇宙中新发现 D.
|
|
| 16. | 详细信息 |
|
下列说法不正确的是( ) A. 金刚石、石英和足球烯均为空间网状结构的原子晶体 B. 在NaOH、NH4Cl和Na2SO4中,都存在离子键和共价键 C. 干冰升华的过程只需克服分子间作用力 D. H2O分解生成H2和O2的过程中既有共价键断裂,又有共价键形成
|
|
| 17. | 详细信息 |
|
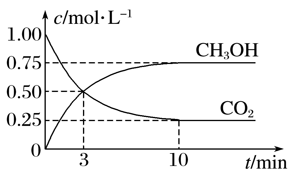
在体积为1 L的密闭容器中(体积不变)充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
A. 3 min前v正>v逆,3 min后v正<v逆 B. 进行到3 min时,正反应速率和逆反应速率相等 C. 10 min后容器中各物质浓度不再改变 D. 达到平衡后,升高温度,正反应速率增大、逆反应速率减小
|
|
| 18. | 详细信息 |
|
对于ⅣA族元素,下列叙述中不正确的是( ) A. SiO2和CO2中Si和O,C和O之间都是共价键 B. C、Si、Ge的最外层电子数都是4,次外层电子数都是8 C. CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 D. 该族元素的主要化合价是+4和+2
|
|
| 19. | 详细信息 |
|
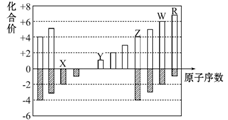
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
A. 原子半径:Z>Y>X B. Z的氧化物能与Y的最高价氧化物对应的水化物反应 C. WX3和水反应生成的化合物是离子化合物 D. 气态氢化物的稳定性:R<W
|
|
| 20. | 详细信息 | ||||||||||
|
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是 ( ) A. a>b>d>c B. b>c>d>a C. a>b>c>d D. d>a>b>c
|
|||||||||||
| 21. | 详细信息 |
|
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
A. 正极反应中有CO2生成 B. 微生物促进了反应中电子的转移 C. 质子通过交换膜从负极区移向正极区 D. 电池总反应为C6H12O6+6O2═6CO2+6H2O
|
|
| 22. | 详细信息 |
|
.X(g)+3Y(g) A. 10min内,消耗0.2 mol X,生成0.4 mol Z B. 第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1 C. 10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1 D. 10min内,X和Y反应放出的热量为a kJ
|
|
| 23. | 详细信息 |
|
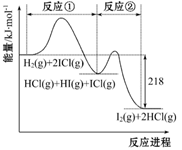
.H2与ICl的反应分①、②两步进行,其能量变化曲线如图所示,下列有关说法错误的是( )
A. 反应①、反应②均为放热反应 B. 反应①、反应②均为氧化还原反应 C. 反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的 ΔH=-218 kJ·mol-1 D. 反应①比反应②的速率慢,与相应断键吸收的能量无关
|
|
| 24. | 详细信息 |
|
下列说法正确的是 ( ) A. 苯与溴水混合后加入FeBr3作催化剂,可发生取代反应生成溴苯 B. 甲烷与氯气混合后光照条件下发生取代反应 C. 相同物质的量的乙烯与乙醇分别在足量的O2中完全燃烧,消耗O2的物质的量不等 D. 乙烯和植物油都能使溴水褪色,其褪色原理不同
|
|
| 25. | 详细信息 |
|
.在一定条件下,可逆反应X(g)+2Y(g) A. 反应放出akJ热量 B. 反应物和生成物的浓度都不再发生变化 C. X和Y的物质的量之比为1∶2 D. X的正反应速率等于Z的逆反应速率
|
|
| 26. | 详细信息 |
|
反应3A(g)+B(g) A. ①>②>③ B. ②>③>① C. ③>①>② D. ②>①>③
|
|
| 27. | 详细信息 |
|
下列说法正确的是 ( ) A. HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物 B. NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键 C. He、CO2和CH4都是由分子构成,它们中都存在共价键 D. 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
|
|
| 28. | 详细信息 |
|
钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )
A. 负极的电极反应式为Fe-3e-=Fe3+ B. 钢铁生锈过程中电能转化为化学能 C. O2在正极参加反应生成OH- D. 为减缓铁制品生锈,可将其与铜相连
|
|
| 29. | 详细信息 |
|
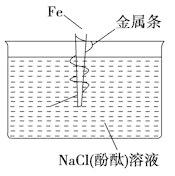
如图,缠上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在金属条表面的溶液出现粉红色。该金属条可能是 ( )。
A. 铜 B. 镁 C. 铝 D. 锌
|
|
| 30. | 详细信息 |
|
.已知反应NH2COONH4(s) A. 密闭容器中氨气的体积分数不变 B. c(NH3)∶c(CO2)=2∶1 C. 密闭容器中的压强不变 D. v(NH3)∶v(CO2)=2∶1
|
|
| 31. | 详细信息 |
|
在一定温度下,反应A2(g)+B2(g) A. 容器内气体的总压强不随时间变化而变化 B. A2、B2和AB的物质的量不再改变 C. c(A2):c(B2):c(AB)=1:1:2 D. A2和B2的物质的量之和与AB的物质的量相等
|
|
| 32. | 详细信息 | |||||||||||||||||||||||||||
|
下表为部分的元素周期表,(用元素符号或化学式回答问题):
(1)元素A离子的结构示意图为______________,单质C的电子式_______________。化合物A2F的电子式_______________,E在元素周期表中的位置第____周期,第____主族。 (2)B单质属于____________(原子晶体、离子晶体、分子晶体) (3)G单质与水的反应方程式为____________________ ; (4)下列说法正确的是 A、离子半径:A+<D2-<F2- B、简单气态氢化物的稳定性:D<F C、G最高氧化物的水化物的碱性比F强 D、E元素的非金属性比D元素强
|
||||||||||||||||||||||||||||
| 33. | 详细信息 |
|
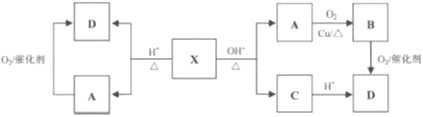
(1)随着人们对环保的重视程度日益提高,乙醇在某些行业作为燃料被广泛应用。下列有关乙醇作为燃料的说法正确的是________。 ①燃烧时只发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种可再生能源 ④燃烧时放出大量的热 A.①②③ B.①②④ C.①③④ D.②③④ (2)CCS技术是将工业和有关能源产业中所产生的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天然气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1 g CH4不完全燃烧反应放出2.21 kJ热量,写出该反应的热化学方程式____________________。
|
|
| 34. | 详细信息 | ||||||||||||||
|
某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
(1)哪一时间段反应速率最大________(填“0~1 min”“1~2 min”“2~3 min”“3~4 min”“4~5 min”或“5~6 min”,下同)。 (2)第3~4 min时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是__________。
|
|||||||||||||||
| 35. | 详细信息 |
|
已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%~5%的D,其转化关系如下图所示。 请回答:
(1)X的结构简式是__________________。 (2)A→B的化学方程式是____________________________________________。 (3)X+H2O→A+D的化学方程式是____________________________________________。 (4)下列说法不正确的是________。 A A+D→X的反应属于加成反应 B A与金属钠反应比水与金属钠反应要剧烈得多 C 除去X中少量D杂质可用饱和Na2CO3溶液 D 等物质的量的A、B、D完全燃烧消耗O2的量依次减小
|
|
| 36. | 详细信息 |
|
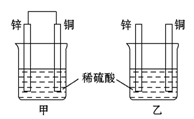
将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是________(填序号)。 A 甲、乙均为化学能转变为电能的装置 B 乙中铜片上没有明显变化 C 甲中铜片质量减少、乙中锌片质量减少 D 两烧杯中H+的浓度均减小 (2)在相同时间内,两烧杯中产生气泡的速率:甲________(填“>”“<”或“=”)乙。 (3)甲烧杯中锌电极为 _________(正极/负极),写出铜极的电极方程式___________ (4)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为________。
|
|
| 37. | 详细信息 |
|
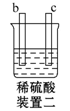
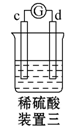
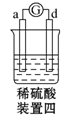
.在烧瓶放20 g蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡。请回答:
(1)仪器a的名称___________ (2)小试管盛装试剂___________ (3)浓硫酸与碳反应方程式___________: (4)下列说法不正确的是___________ A 蔗糖变黑说明发生过程 C12H22O11→C+H2O B 品红颜色变淡说明SO2有漂白性 C 上述实验体现浓硫酸的脱水性、吸水性和氧化性 D 将气体依次通过饱和碳酸氢钠溶液、澄清石灰水,石灰水变浑浊证明含有CO2
|
|
 D.
D.