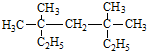2019河北高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
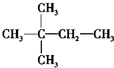
正丁烷和异丁烷互为同分异构体,下列关于它们的说法不正确的是( ) A. 具有相似的化学性质 B.具有相同的物理性质 C. 是不同的物质 D.分子式相同,但分子内碳原子的连接方式不同
|
|
| 2. | 详细信息 |
|
下列关于烷烃性质的叙述中,不正确的是( ) A.烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高,常温下的状态由气态递变到液态,相对分子质量大的则为固态 B.烷烃同系物的密度随相对分子质量增大逐渐增大 C.烷烃跟卤素单质在光照条件下能发生取代反应 D.烷烃同系物都能使溴水、酸性KMnO4溶液褪色
|
|
| 3. | 详细信息 |
|
下列物质,不可能是乙烯的加成产物的是( ) A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
|
|
| 4. | 详细信息 |
|
下列用系统命名法命名的烷烃名称正确的是( ) A.2-甲基-3-乙基戊烷 B.3,4,4-三甲基己烷 C.2-甲基-4-乙基戊烷 D.1,2-二甲基丁烷
|
|
| 5. | 详细信息 |
|
若要使0.5mol甲烷完全和Cl2发生取代反应,并生成相同物质的量的四种取代物,则需要Cl2的物质的量为( ) A.2.5 mol B.2 mol C.1.25 mol D.0.5 mol
|
|
| 6. | 详细信息 |
|
下列关于烷烃与烯烃的性质及反应类型叙述正确的是( )
|
|
| 7. | 详细信息 |
|
甲烷分子的空间构型是正四面体,下列事实可以证明这一观点的是 A.CH3Cl没有同分异构体 B.CH2Cl2没有同分异构体 C.甲烷分子中C—H键键角均相等 D.甲烷分子可以发生取代反应
|
|
| 8. | 详细信息 |
|
常温常压下,一种气态烷烃与一种气态烯烃的混和物共2升,完全燃烧后,恢复到原状况,得到2.4升二氧化碳.则该混和气体中一定含有( )
|
|
| 9. | 详细信息 |
|
下列 A.乙烯使酸性KMnO4溶液褪色 B.将CCl4滴入溴水中,振荡后水层接近无色 C.乙烯使溴水褪色 D.甲烷与氯气混合,光照一段时间后黄绿色消失
|
|
| 10. | 详细信息 |
|
除去乙烷中混有的少量乙烯,应采用的简便方法是( )。 A.将混合气体通过氢氧化钠溶液 B.将混合气体通过溴水 C.将混合气体在催化剂条件下跟氢气反应 D.使混合气
|
|
| 11. | 详细信息 |
|
将29.5 g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重7 g,则混合气体中乙烯的体积分数是( )。 A.75% B.50% C.30% D.25%
|
|
| 12. | 详细信息 |
|
下 A.乙烷与氯气光照反应 C.乙烯与氯气混合 D.
|
|
| 13. | 详细信息 |
|
使1 mol乙烯与氯气发生加成反应,并反应完全,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,并反应完全,则两个过程中共消耗氯气( ) A.3 mol B.4 mol C.5 mol
|
|
| 14. | 详细信息 |
|
下列说法正确的是( )
|
|
| 15. | 详细信息 |
|
下列烷烃中,不能由相应的烯烃与H2加成制得的是( ) A.
|
|
| 16. | 详细信息 |
|
已知:H2O(g)===H2O(l) ΔH=Q1 kJ·mol-1 C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol-1 C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol-1 若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( ) A.(Q1+Q2+Q3) kJ B.0.5(Q+Q2+Q3) kJ C.(0.5Q1-1.5Q2+0.5Q3) kJ D.(3Q1-Q2+Q3) kJ
|
|
| 17. | 详细信息 |
|
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的体积分数接近于( ) A.5% B.10% C.15% D.20%
|
|
| 18. | 详细信息 |
|
对可逆反应4NH3(g)+5O2(g) A.达到化学平衡时4v正(O2)=5v逆(NO) B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大 D.化学反应速率关系:2v正(NH3)=3v正(H2O)
|
|
| 19. | 详细信息 |
|
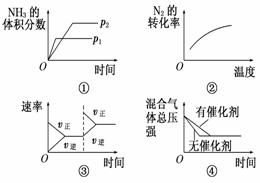
对于可逆反应N2(g)+3H2(g)
A.①压强对反应的影响(p2>p1) B.②温度对反应的影响 C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响
|
|
| 20. | 详细信息 |
|
.某温度下,可逆反应mA(g)+ A.K值越大,表明该反应越有利于C的生成,达到平衡时反应物的转化率越大 B.若缩小反应器的容积,能使平衡正向移动,则K增大 C.温度越高,K一定越大 D.如果m+n=p,则K=1
|
|
| 21. | 详细信息 |
|
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图19,下列说法正确的是( ) ①若a<4,则A、B都是弱酸 ②稀释后,A酸溶液的酸性比B酸溶液强 ③若a=4,则A是强酸,B是弱酸 ④A、B两种酸溶液的物质的量浓度一定相等 A.①④ B.②③ C.①③ D.②④
|
|
| 22. | 详细信息 |
|
在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( ) A.c(Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH-) C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
|
|
| 23. | 详细信息 |
|
已知水的电离平衡曲线如图所示,下列说法正确的是( )。 A.水的离子积常数 B.向水中加入醋酸钠固体,可以从C点到D点 C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 D.升高温度可实现由C点到D点
|
|
| 24. | 详细信息 |
|
某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如下所示的四个实验方案,你认为可行的方案是( )
|
|
| 25. | 详细信息 |
|
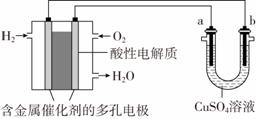
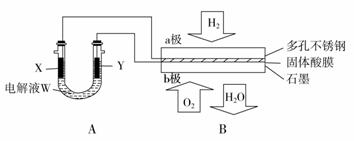
用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法中正确的是 ( )
A.燃料电池工作时,正极反应:O2+2H2O+4e-===4OH- B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
|
|
| 26. | 详细信息 |
|
(1)分子中含有16个共价键的烷烃的分子式是____________,1mol该烷烃与氯气发生取代反应,当烷烃中的氢全部被取代后,消耗氯 (3)某气态烷烃和乙烯等体积混合时,1体积混合气体完全燃烧消耗同温同压下4.75体积氧气.试回答: (4)按系统命名法命名:
|
|
| 27. | 详细信息 |
|
如下图装置所示,是用氢氧燃料电池B进行的某电解实验:
(1)若电池B使用了亚氨基锂(Li A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂 C.Li+和H-的离子半径相等 D.此法储氢和钢瓶储氢的原理相同 (2) ①b极上的电极反应式为____________ ②外电路中,每转移0.1 mol电子,在a极消耗________ L的H2(标准状况下)。 (3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时: ①电解池中X极上的电极反应式是______________。在X极这边观察到的现象是____________。 ②检验Y电极上反应产物的方法是______________。 ③若A中其他均不改变,只将电极Y换成铁棒,写出电池总反应式____________________。
|
|
| 28. | 详细信息 |
|
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡4种,且均符合平衡移动原理.请回答下列问题:
|
|
| 29. | 详细信息 | ||||||||||||||||||||||||
|
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题: ______ .
依据上表数据计算该H2C2O4溶液的物质的量浓度为 ______ mol/L(保留4位有效数字). |
|||||||||||||||||||||||||