2017河北高三下学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
下列说法正确的是 A.CO2的电子式为 B.浓H2SO4试剂瓶上应贴上危险警告标签 C.根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 D.核内打8个中子的碳原子可表示为86C |
|
| 2. | 详细信息 |
|
NA为阿伏加德罗常数的值,下列说法中正确的是 A.22.4LNH3分子中含有3NA个N—H键 B.2.3 g Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA C.1 L0.1 mol·L-1蔗糖溶液中所含分子数为0.1NA D.常温常压下,46g NO2含有的原子数小于3NA |
|
| 3. | 详细信息 |
|
下列实验设计及其对应的离子方程式均正确的是 A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2++2Fe2+ B.Na2O2 与H2O反应制备O2:Na2O2+H2O = 2Na++ 2OH-+O2↑ C.硫化钠水溶液呈碱性的原因:S2-+2H2O D.铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
|
| 4. | 详细信息 | |||||||||||||||||||||||||
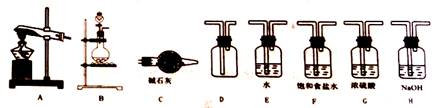
|
用下图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
|
||||||||||||||||||||||||||
| 5. | 详细信息 |
|
M是中药狼把草的成分之一,具有消炎杀菌作用,其结构如图所示。下列叙述正确的是
A.M的分子式为C9H10O4 B. M与浓溴水既能发生取代反应,又能发生加成反应 C.—定条件下,1 mol M最多能与3molH2发生反应 D.M能分别与Na、NaOH、NaHCO3发生反应 |
|
| 6. | 详细信息 |
|
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,X是周期表中原子半径最小的元素,Y的最高正价与最低负价绝对值相等,W最外层电子数是最内层电子数的3倍,R是同周期元素中原子半径最小的元素。下列说法不正确的是 A.原子半径Z>W>R B.对应的氢化物的热稳定性:R>W>Y C.单质Z可与R的最高价含氧酸发生置换反应 D.W与R所形成的简单离子均能影响水的电离平衡 |
|
| 7. | 详细信息 |
|
某温度下,向一定体积0.1 mol·L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示。 下列说法错误的是
A.此温度下,水的离子积常数为1.0×10-2x B.M、N两点所示的溶液中,水的电离程度相同 C.Q点消耗的NaOH溶液的体积等于HA溶液的体积 D.N点溶液加水稀释, |
|
| 8. | 详细信息 |
|
SO2是大气污染物之一,某同学在实验室中对SO2与氯水的反应进行了探究。 制备SO2与氯水可供选择的仪器如图所示,请回答下列问题:
(1)该同学选用KMnO4和浓盐酸快速制备Cl2,该反应的离子方程式为________。 预制备一瓶饱和氯水,请选择上图中的装罝,其连接顺序为:_____(按气流方向,用字母衣示)。 (2)制备SO2的适宜药品为___________ (填代号)。 ①Na2SO3固体②Na2SO3溶液③20%硫酸④70%硫酸⑤铜片 (3)对SO2与氯水的反应进行探究 ①用注射器吸入一定量的饱和氯水和SO2,震荡,静置,再吸入少量品红溶液,发现品红溶液不褪色,解释其原因(用化学反应方程式表示)__________________。 ②改变氯水用量,重复①操作,发现品红溶液红色褪色,你认为可能的原因是____________。 设计一个实验(说明操作方法、现象及结论)来验证你的假设:_________________________。 (4)请你设计一个实验,测定饱和氯水中氯元素的含量:______________________________。 |
|
| 9. | 详细信息 |
|
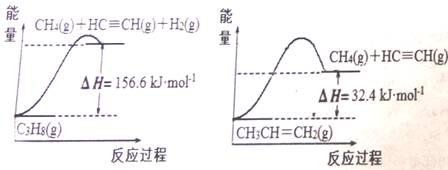
碳氢化合物是重要的能源物质。 (1)丙烷脱氢可得丙烯。己知:有关化学反应的能量变化如下图所示。
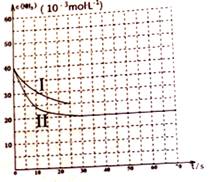
则相同条件下,反应C3H8(g) (2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池正极反应式为_______________________。 (3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3) = 1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 (4)用氨气制取尿素的反应为: 2NH3(g)+ CO2(g) ==CO(NH2)2 (l)+H2O(g) △H<0 某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。 ①理论上生产尿素的条件是______。(填选项编号) A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压 ②下列描述能说明反应达到平衡状态的是_____________。 A.反应混合物中CO2和H2O的物质的量之比为1:2 B.混合气体的总质量不随时间的变化而变化 C.单位时间内消耗2a molNH3,同时生成a molH2O D.保持温度和容积不变,混合气体的压强不随时间的变化而变化 ③该温度下此反应平衡常数K的值为____________。 ④图中的曲线I表示该反应在前25s内的反应进程中的NH3浓度变化.。在0~25s内该反应的平均反应速率v(CO2)=___________。
保持其它条件不变,只改变一种条件,图像变成II,则改变的条件可能是_______________。 |
|
| 10. | 详细信息 |
|
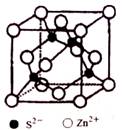
明代宋应星所著《天工开物》中己经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题: (1) Zn原子基态核外电子排布式为___________________。 (2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。 ①SO42-中心原子的轨道杂化类型为_____,与它互为等电子体的阴离子化学式为____(写出一种)。 ②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为___,提供孤电子对的成键原子是____。 ③氨的热稳定性强于膦(PH3),原因是_______。 (3)黄酮是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是_____________。 (4)《本草纲自》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。 Zn、C、O电负性由大至小的顺序是________。ZnCO3中阴离子的立体构型是______。 (5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为____________。
晶胞边长为a pm,阿伏加德罗常数为NA,则ZnS晶体的密度为_____g/cm3 (列出计算式即可) |
|
| 11. | 详细信息 |
|
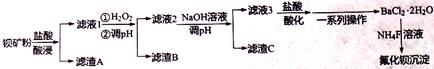
氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成份为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
(2)滤液1加H2O2氧化过程主要反应的离子方程式为_______________________。 (3)加20°/。NaOH溶液调节pH=12.5,得到滤渣C的主要成分是 ____________________。 (4)滤液3加入盐酸酸化后再经_____、冷却结晶、_______、洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。 (5)常温下,用BaCl2·2H2O配制成0.2mol/L水溶液与等浓度的氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式__________________。己知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5L),至少需要的氟离子浓度是_____ mol/L (结果保留三位有效数字)。(己知 (6)己知:Ksp (BaCO3 =2.58×10-9,Ksp (BaSO4)=1.07×10-10。将氯化钡溶液滴入等物质的量浓度的硫酸钠和碳酸钠混合液中,当BaCO开始沉淀时,溶液中 |
|
| 12. | 详细信息 |
|
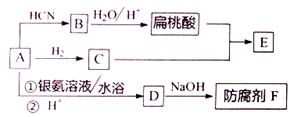
A为一种工业中广泛使用的芳香族化合物,下面是以A为原料制备E (酯)的合成路线:
已知以下信息: ①A的相对分子质量在100〜110之间,其中氧元素质量分数为15.1% ② ③扁桃酸的结构简式为 回答下列问题: (1)防腐剂F的化学名称是______,A与HCN反应生成B的反应类型是______________ 。 (2)己知E的分子式为C15H14O3,则C的分子式为_______,E的结构简式为________。 (3) A发生银镜反应的化学方程式是_______________________________。 (4)扁桃酸 (不考虑立体异构):①能发生水解反应;②能与氯化铁溶液发生显色反应:③苯环上有两个取代基。请写出其中核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式___________。 (5)写出以C2H5OH为原料,合成聚乳酸( |
|

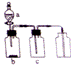


 )
)


