2017四川高三下学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
分类是化学学习与研究的常用方法,下列分类正确的是 ①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物; ②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质; ③Na2O、Fe2O3、A12O3属于碱性氧化物 ④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液; ⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应; ⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物 ⑦根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 A.只有②④⑥⑦ B.只有①③⑤⑦ C.只有③④⑥ D.只有①②⑤
|
|
| 2. | 详细信息 |
|
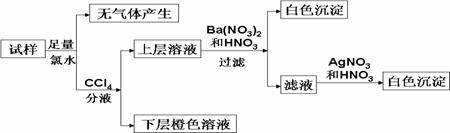
某无色溶液中可能含有Na+、K+、
则关于原溶液的判断中不正确的是 A.肯定不存在的离子是Fe3+、Cu2+、 B.肯定存在的离子是 C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断 无影响 D.无法确定原溶液中是否存在
|
|
| 3. | 详细信息 |
|
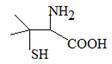
青霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X。已知X的结构如下,下列有关X的说法正确的是
B.X的分子式为C5H10NO2S C.X只能发生取代反应 D.X中碳原子上的H若有1个被Cl取代,有2种不同产物
|
|
| 4. | 详细信息 | ||||||||||||||||||||
|
下列实验所用试剂、现象和结论均正确的是
A.①③ B.①② C.②④ D.②③
|
|||||||||||||||||||||
| 5. | 详细信息 | ||||||||
|
X、Y、Z、W均为短周期元素,且Y、Z、W在周期表的位置关系如下。已知X与W能形成最简单的有机物,则下列有关说法正确的是 A.X能分别与Y、W形成化合物,且其所含化学键类型完全相同
B.W有多种同素异形体,且均具有高熔点、高沸点的性质 C.X的离子半径一定小于与Y同族的短周期元素的离子半径 D.Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z
|
|||||||||
| 6. | 详细信息 |
|
有一种新型的锂电池,其制作是利用了金属锂和石墨作电极,其电解质溶液是四氯合铝酸锂(LiAlCl4)溶解在二氯亚硫酰(其化学式是SOCl2)中形成的,原电池的电极总反应式是:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是 A.锂作为电池的负极,石墨作电池的正极 B.电池工作过程中,SOCl2被还原为Li2SO3 C.该电池内环境应该是无水环境,否则影响电池的寿命 D.电池工作时,锂提供的电子的物质的量与析出硫的物质的量之比是4∶1
|
|
| 7. | 详细信息 |
|
下列溶液中各微粒的浓度关系不正确的是 A、0.1 mol·L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) B、等浓度、等体积的Na2CO3和NaHCO3混合: C、0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
|
|
| 8. | 详细信息 | |||
|
硫代硫酸钠是一种重要的化工产品。某兴趣 小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。 Ⅰ.【查阅资料】 (1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。 (2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和 Na2SO4。 (3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。 Ⅱ.【制备产品】 实验装置如图所示(省略夹持装置):
实验步骤: (1) 检查装置A、B气密性的方法是 ,如图示加入试剂。仪器b的名称是________;E中的试剂是________(选填下列字母编号)。 A.稀H2SO4 B.饱和Na2SO3溶液 C.饱和NaHSO3溶液 D.NaOH溶液 (2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。 (3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、________、干燥、得到产品。(填写操作名称) Ⅲ.【探究与反思】 (1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完 整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择) 取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成, ______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。 (2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了 改进,改进后的操作是__________________________________ 。 (3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过______ 方法提纯。
|
||||
| 9. | 详细信息 | ||
|
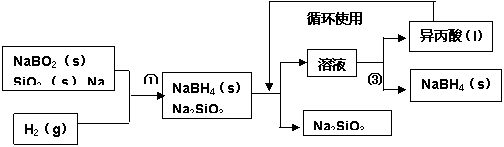
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下: ② 已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。 (1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是: 。 (2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2———— NaBH4+ Na2SiO3 (3)第②步操作需要的玻璃仪器有: ;第③步分离出NaBH4并回收溶剂,采用的操作方法是 。 (4)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为: ,反应消耗1molNaBH4时转移的电子数目为 NA。
|
|||
| 10. | 详细信息 |
|
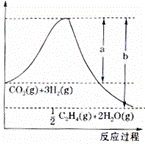
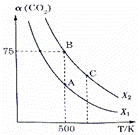
(1)若该反应体系的能量随反应过程变化关系如图所示, 则该反应的 (2)几种化学键的键能如表所示,实验测得 上述反应的
① 平衡常数 ②若B点时X=3,则平衡常数KB= (代入数据列出算式即可)。 ③下列措施能同时满足增大反应速率和提高CO2转化率的是 。 a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来
该电解池中所发生的总反应的 化学方程式为 。
|
|
| 11. | 详细信息 |
|
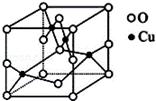
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等。回答下列问題: ⑴二价铜离子的电子排布式为 ,已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
阴离子的个数为 。 ⑶往硫酸铜溶液中加入过量氨水,可生成2+配离子。 已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+ 形成配离子,其原因是 。 ⑷铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类 卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C =S)的沸点。其原因是 。 ⑸硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3 能与NH3反应生成BF3•NH3,在BF3•NH3中B原子的杂化方式为 ,B与N之间形成
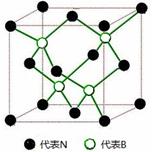
⑹六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。六 方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞结构 如下图所示,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。 (只要求列算式)。
|
|
| 12. | 详细信息 |
|
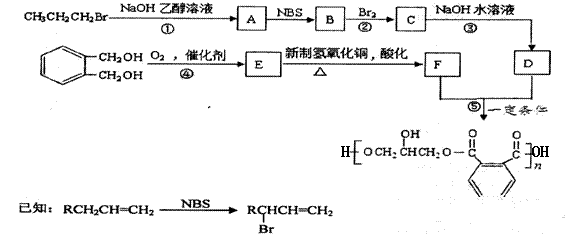
【化学——选修5:有机化学基础】(15分) 某树脂的合成线路如下:
(1)B中含有的官能团的名称是________________________。 (2)反应①、③的有机反应类型分别是________________、____________________。 (3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是 。 (4)下列说法正确的是__________(填字母编号)。 a.1 mol E与足量的银氨溶液反应能生成2mol Ag b.可以用NaHCO3鉴别E和F c.B分子存在顺反异构 (5)写出反应⑤的化学方程式______________________________________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
|
|