2018高一下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
A.51 B.92 C.143 D.235
|
|
| 2. | 详细信息 |
|
下列各组物质中,互为同素异形体的是 A.T2O与D2O B.O2和O3 C.4019K与4020Ca D.21H和31H
|
|
| 3. | 详细信息 |
|
下列晶体或分子中,含有化学键类型有差异的一组是 A.NH3、NO2 。 B.NaCl、KF C.NaOH、Ca(OH)2 D.MgO、H2O2
|
|
| 4. | 详细信息 |
|
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是 A.离子半径:X+> Y3+> Z2- B.碱性:XOH > Y(OH)3 C.单质的还原性:X > Y D.原子序数:Y > X > Z
|
|
| 5. | 详细信息 |
|
反应 A + 3B (1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s) (3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s),则该反应速率的快慢顺序为 A.(2)>(4)>(3)>(1) B.(2)>(3)= (4)>(1) C.(1)>(4)>(2)= (3) D.(4)>(3)>(2)>(1)
|
|
| 6. | 详细信息 |
|
下列关于卤素(用X表示)叙述正确的是 A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐降低 B.单质和水反应通式是:X2+ H2O C.单质和氢气反应的通式是:X2+ H2 D.随着卤素核电荷数的增多,单质的氧化性逐渐增强,阴离子还原性逐渐减弱
|
|
| 7. | 详细信息 |
|
在一定温度下,反应A2(g)+B2(g) A.单位时间内生成n molA2同时生成n molAB B.容器内的总物质的量不随时间变化 C.单位时间内生成2n molAB的同时生成n molB2 D.单位时间内生成n molA2的同时生成n molB2
|
|
| 8. | 详细信息 |
|
下列各组性质比较中,不正确的是 A.酸性:HClO4>HBrO4>HIO4 B.碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 C.氧化性:F2<Br2<I2 D.还原性:Li<Na<K
|
|
| 9. | 详细信息 |
|
已知R2+离子核外有a个电子,核内有b个中子,下列表示R原子符号正确的是 A.
|
|
| 10. | 详细信息 |
|
下列变化过程,属于放热反应的是 ①碳与水蒸气生成一氧化碳和氢气 ②酸碱中和反应 ③铝粉与氧化铁粉末反应 ④固体NaOH溶于水 ⑤H在Cl2中燃烧 ⑥碳酸钙高温分解 A.②③④⑤ B.②④⑤ C.②③⑤ D.①③⑤
|
|
| 11. | 详细信息 |
|
反应A(s)+B(g) A.升高温度 B.增加A的物质的量 C.使用催化剂 D.缩小容器体积使压强增大
|
|
| 12. | 详细信息 |
|
电池是人类生产和生活中重要的能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能 C.氢氧燃料电池工作时氢气在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
|
|
| 13. | 详细信息 |
|
下列有关物质性质的比较正确的是 ①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高 ②元素的非金属性越强,气态氢化物的热稳定性越弱 ③单质与水反应的剧烈程度:F2>Cl2>Br2>I2 ④元素的非金属性越强,它的气态氢化物水溶液的酸性越强 ⑤还原性:S2﹣>Se2﹣ ⑥酸性:HNO3>H3PO4 A.①③ B.②④ C.③⑥ D.⑤⑥
|
|
| 14. | 详细信息 |
|
下列有关反应速率的说法正确的是 A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 B.100 mL 2 mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
|
|
| 15. | 详细信息 |
|
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 A.金属性:Y>Z B.氢化物的稳定性:X>W C.离子的还原性:X>W D.离子半径:Z>Y>X
|
|
| 16. | 详细信息 |
|
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g) A.v(X)正=v(X)逆=0 B.v(X):v(Y)=l:2 C.容器内X、Y、Z的浓度不随时间变化 D.单位时间消耗0.1 mol X同时生成0.2mol Z
|
|
| 17. | 详细信息 |
|
短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答: (1)X元素的名称: ,Y元素在元素周期表中的位置 ,Z元素的原子结构示意图 。 (2)Y2X对应水化物的电子式 ,其中存在的化学键有 。 (3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因 。
|
|
| 18. | 详细信息 | ||||||||||||||
|
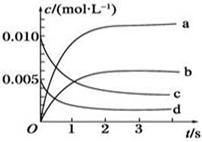
在2L密闭容器中,800℃时反应2NO(g)+O2(g)
(1)上述反应 (填“是”或“不是”)可逆反应。 (2)如图所示,表示NO2变化曲线的是 ,用O2表示从0~2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 (填序号)。 a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
|
|||||||||||||||
| 19. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下表是周期表中的一部分,根据①~⑩在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,还原性最强的单质是 ,可用于制半导体材料的元素是 ; (2)最高价氧化物的水化物酸性最强的是 ,呈两性的是 ,最高价氧化物的水化物碱性最强的是 ,电子式为 ; (3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是 ; (4)比较⑥⑦⑨氢化物的稳定性最弱的是 ; (5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为 ; (6)铍(Be)位于元素周期表中第二周期第ⅡA族。相同条件下,单质铍与酸反应比单质锂与酸反应更加 (填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 。
|
|||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)X的转化率是 ; (2)由图中所给数据进行分析,该反应的化学方程式为 ; (3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ; (4)下列选项中,能判断该反应达平衡状态的是 。 A.消耗3molX的同时,消耗1molY B.X、Y、Z三种物质的浓度不再发生变化 C.生成1molY的同时,生成2molZ D.X的物质的量不再发生变化
|
|
| 21. | 详细信息 |
|
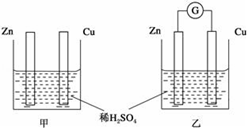
Ⅰ分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计,请回答下列问题:
(1)以下叙述中,正确的是 。 A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生 C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢 E.乙的外电路中电流方向Zn→Cu (2)变化过程中能量转化的形式主要是:甲为 ;乙为 。 (3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: 。 Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。 (1)如果是碱性燃料电池则负极反应方程式是: 。 (2)如果是酸性燃料电池则正极反应方程式是: 。
|
|