2016й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ жҖ§иҙЁе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–зҡ„еҶіе®ҡеӣ зҙ жҳҜ(гҖҖгҖҖ) A.е…ғзҙ еҺҹеӯҗеҚҠеҫ„еӨ§е°Ҹе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– B.е…ғзҙ зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдҫқж¬ЎйҖ’еўһ C.е…ғзҙ еҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– D.е…ғзҙ зҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBдёӨз§ҚеҺҹеӯҗпјҢAзҡ„Mз”өеӯҗеұӮжҜ”Bзҡ„Mз”өеӯҗеұӮе°‘3дёӘз”өеӯҗпјҢBзҡ„Lз”өеӯҗеұӮз”өеӯҗж•°жҒ°дёәAзҡ„Lз”өеӯҗеұӮз”өеӯҗж•°зҡ„2еҖҚгҖӮAе’ҢBеҲҶеҲ«жҳҜ(гҖҖгҖҖ) A.зЎ…еҺҹеӯҗе’Ңй’ еҺҹеӯҗВ В В В В В В В В В В В В В B.зЎјеҺҹеӯҗе’Ңж°ҰеҺҹеӯҗ C.ж°ҜеҺҹеӯҗе’ҢзўіеҺҹеӯҗВ В В В В В В В В В В В В В D.зўіеҺҹеӯҗе’Ңй“қеҺҹеӯҗ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
A.еҺҹеӯҗеҚҠеҫ„пјҡWпјһZпјһYпјһX B.жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§WжҜ”Zејұ C.Yзҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§иҫғZзҡ„ејұ D.еӣӣз§Қе…ғзҙ зҡ„еҚ•иҙЁдёӯпјҢZзҡ„зҶ”гҖҒжІёзӮ№жңҖй«ҳ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢж—ўеҗ«зҰ»еӯҗй”®гҖҒеҸҲеҗ«е…ұд»·й”®зҡ„жҳҜ(гҖҖгҖҖ) A.NaOHВ В В В В В В В В В В В В В В В В В В В В В В B.Na2O C.H2OВ В В В В В В В В В В В В В В В В В В В В В D.CaCl2
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–дёӯеұһдәҺеҗёзғӯеҸҚеә”зҡ„жҳҜ(гҖҖгҖҖ) в‘ ж¶ІжҖҒж°ҙжұҪеҢ–В В В гҖҖв‘Ўе°ҶиғҶзҹҫеҠ зғӯеҸҳжҲҗзҷҪиүІзІүжң«гҖҖВ В В В в‘ўжө“зЎ«й…ёзЁҖйҮҠгҖҖ в‘Јж°Ҝй…ёй’ҫеҲҶи§ЈеҲ¶ж°§ж°”В В В В В В гҖҖв‘Өз”ҹзҹізҒ°и·ҹж°ҙеҸҚеә”з”ҹжҲҗзҶҹзҹізҒ° A.в‘ в‘ЈВ В В В В В В B.в‘Ўв‘ў В В В В В В C.в‘ в‘Јв‘Ө В В В В В D.в‘Ўв‘Ј
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
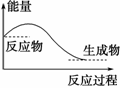
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
B.H2O(g)вҖ•вҶ’H2O(l)иҜҘиҝҮзЁӢж”ҫеҮәеӨ§йҮҸзҡ„зғӯпјҢжүҖд»ҘиҜҘиҝҮзЁӢжҳҜеҢ–еӯҰеҸҳеҢ– C.еҢ–еӯҰеҸҚеә”дёӯиғҪйҮҸзҡ„еҸҳеҢ–йғҪиЎЁзҺ°дёәзғӯйҮҸзҡ„еҸҳеҢ– D.еҜ№дәҺеҰӮеӣҫжүҖзӨәзҡ„иҝҮзЁӢпјҢжҳҜеҗёж”¶иғҪйҮҸзҡ„иҝҮзЁӢ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјүгҖӮ в‘ з”өи§ЈжҳҜжҠҠз”өиғҪиҪ¬еҢ–дёәеҢ–еӯҰиғҪгҖҖв‘Ўз”өи§ЈжҳҜжҠҠеҢ–еӯҰиғҪиҪ¬еҢ–дёәз”өиғҪгҖҖв‘ўз”өи§ЈиҙЁжә¶ж¶ІеҜјз”өжҳҜеҢ–еӯҰеҸҳеҢ–пјҢйҮ‘еұһеҜјз”өжҳҜзү©зҗҶеҸҳеҢ–гҖҖв‘ЈдёҚиғҪиҮӘеҸ‘иҝӣиЎҢзҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢйҖҡиҝҮз”өи§Јзҡ„еҺҹзҗҶжңүеҸҜиғҪе®һзҺ°гҖҖв‘Өд»»дҪ•жә¶ж¶Іиў«з”өи§ЈпјҢеҝ…е°ҶеҜјиҮҙж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„еҸ‘з”ҹ AпјҺв‘ в‘Ўв‘ўв‘ЈВ В В В В В BпјҺв‘ в‘ўв‘Јв‘ӨВ В В В В В CпјҺв‘ўв‘ЈВ В В В DпјҺв‘Ўв‘ўв‘Ј
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёй“ҒзүҮдёҺзЁҖзЎ«й…ёеҸҚеә”еҲ¶еҸ–ж°ўж°”ж—¶пјҢдёӢеҲ—зҡ„жҺӘж–ҪдёӯпјҢдёҚиғҪдҪҝж°ўж°”з”ҹжҲҗйҖҹзҺҮеҠ еҝ«зҡ„жҳҜ A. еҠ зғӯВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В B. дёҚз”ЁзЁҖзЎ«й…ёпјҢж”№з”Ё98п№Әжө“зЎ«й…ё CпјҺж»ҙеҠ е°‘йҮҸзЎ«й…ёй“ңжә¶ж¶ІВ В В В В В В В В В В В В В В В В В В В DпјҺдёҚз”Ёй“ҒзүҮпјҢж”№з”Ёй“ҒзІү
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҶіе®ҡеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„дё»иҰҒеӣ зҙ жҳҜВ В AпјҺеҸӮеҠ еҸҚеә”зҡ„зү©иҙЁжң¬иә«зҡ„жҖ§иҙЁВ В В В В В В В В В BпјҺеӮ¬еҢ–еүӮ CпјҺжё©еәҰгҖҒеҺӢејәд»ҘеҸҠеҸҚеә”зү©зҡ„жҺҘи§ҰйқўВ В В В В В DпјҺеҸҚеә”зү©зҡ„жө“еәҰ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҚеә”4NH3(g) + 5O2(g) AпјҺv (O2)= 0.01molВ·(LВ·s)вҖ“1В В В В В В В В В В В В В BпјҺv (NO)= 0.008molВ·(LВ·s)вҖ“1 CпјҺv (H2O)= 0.003molВ·(LВ·s)вҖ“1В В В В В В В В В В В DпјҺv (NH3)= 0.02molВ·(LВ·s)вҖ“1
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеңЁ550в„ғж—¶пјҢдёҖе®ҡе®№з§Ҝзҡ„е®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”пјҡ2SO2+O2 AпјҺSO2е’ҢSO3жө“еәҰзӣёзӯүВ В В В В В В В В В В В В В В В BпјҺSO3зҡ„з”ҹжҲҗйҖҹзҺҮдёҺSO2зҡ„ж¶ҲиҖ—йҖҹзҺҮзӣёзӯү CпјҺе®№еҷЁдёӯж°”дҪ“зҡ„еҺӢејәдёҚеҸҳВ В В В В В В В В В В В В DпјҺе®№еҷЁдёӯж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
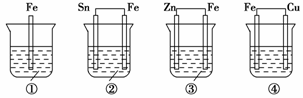
еҰӮеҸіеӣҫжүҖзӨәиЈ…зҪ®пјҢз”өжөҒиЎЁжҢҮй’ҲеҸ‘з”ҹеҒҸиҪ¬пјҢеҗҢж—¶AжһҒйҖҗжёҗеҸҳзІ—пјҢBжһҒйҖҗжёҗеҸҳз»ҶпјҢCдёәз”өи§ЈиҙЁжә¶ж¶ІпјҢеҲҷAгҖҒBгҖҒCеә”жҳҜдёӢеҲ—еҗ„з»„дёӯзҡ„(гҖҖгҖҖ) A.AжҳҜZnпјҢBжҳҜCuпјҢCдёәзЁҖзЎ«й…ё B.AжҳҜCuпјҢBжҳҜZnпјҢCдёәзЁҖзЎ«й…ё C.AжҳҜFeпјҢBжҳҜAgпјҢCдёәзЁҖAgNO3жә¶ж¶І D.AжҳҜAgпјҢBжҳҜFeпјҢCдёәзЁҖAgNO3жә¶ж¶І
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ„зғ§жқҜдёӯзӣӣжңүжө·ж°ҙпјҢй“ҒеңЁе…¶дёӯиў«и…җиҡҖз”ұеҝ«еҲ°ж…ўзҡ„йЎәеәҸдёә(гҖҖгҖҖ)
A.в‘Ўв‘ в‘ўв‘Ј В В В В В B.в‘Јв‘ўв‘ в‘ЎВ В В В В C.в‘Јв‘Ўв‘ в‘ўВ В В В D.в‘ўв‘Ўв‘Јв‘
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.й•Қж°ўз”өжұ гҖҒй”Ӯз”өжұ е’ҢзўұжҖ§й”Ңй”°е№Із”өжұ йғҪжҳҜдәҢж¬Ўз”өжұ B.зҮғж–ҷз”өжұ жҳҜдёҖз§Қй«ҳж•ҲдҪҶжҳҜдјҡжұЎжҹ“зҺҜеўғзҡ„ж–°еһӢз”өжұ C.еҢ–еӯҰз”өжұ зҡ„еҸҚеә”еҹәзЎҖжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” D.й“…и“„з”өжұ ж”ҫз”өзҡ„ж—¶еҖҷжӯЈжһҒжқҗж–ҷжҳҜPbпјҢиҙҹжһҒжқҗж–ҷжҳҜPbO2
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іиғҪжәҗзҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ) A.йЈҺиғҪжҳҜдәәзұ»йҖҡиҝҮйЈҺиҪҰзӯүе·Ҙе…·иҺ·еҸ–зҡ„иғҪжәҗпјҢдҪҶеұһдәҺдёҖж¬ЎиғҪжәҗ B.еңЁеҚіе°ҶеҲ°жқҘзҡ„ж–°иғҪжәҗж—¶д»ЈпјҢж ёиғҪгҖҒеӨӘйҳіиғҪгҖҒж°ўиғҪе°ҶжҲҗдёәдё»иҰҒиғҪжәҗ C.жңҲзҗғеңҹеЈӨдёӯеҗ«жңүдё°еҜҢзҡ„иҙЁйҮҸж•°дёә3зҡ„ж°ҰпјҢе®ғеҸҜдҪңдёәжңӘжқҘж ёиғҪзҡ„йҮҚиҰҒеҺҹж–ҷ D.еҺҹз”өжұ жҠҠеҢ–еӯҰиғҪзӣҙжҺҘиҪ¬еҢ–дёәз”өиғҪпјҢжүҖд»Ҙз”ұеҺҹз”өжұ жҸҗдҫӣзҡ„з”өиғҪжҳҜдёҖж¬ЎиғҪжәҗ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||
|
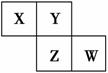
дёӢиЎЁдёәе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢиҜ·еӣһзӯ”жңүе…ій—®йўҳпјҡ
(1)в‘Өе’Ң⑧зҡ„е…ғзҙ з¬ҰеҸ·еҲҶеҲ«жҳҜ__________е’Ң_______________________гҖӮ (2)иЎЁдёӯжңҖжҙ»жіјзҡ„йҮ‘еұһжҳҜ__________пјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜ__________гҖӮ(еЎ«еҶҷе…ғзҙ з¬ҰеҸ·) (3)иЎЁдёӯиғҪеҪўжҲҗдёӨжҖ§ж°ўж°§еҢ–зү©зҡ„е…ғзҙ жҳҜ__________пјҢеҲҶеҲ«еҶҷеҮәиҜҘе…ғзҙ зҡ„ж°ўж°§еҢ–зү©дёҺв‘Ҙе’Ңв‘ЁжңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ _____________________________гҖӮ (4)иҜ·и®ҫи®ЎдёҖдёӘе®һйӘҢпјҢжҜ”иҫғв‘Ұв‘©еҚ•иҙЁж°§еҢ–жҖ§зҡ„ејәејұпјҡ_______________________________гҖӮ
|
|||||||||||||||||||||||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢйқўжҳҜеҗҢеӯҰ们зҶҹжӮүзҡ„зү©иҙЁпјҡ в‘ O2гҖҖв‘ЎйҮ‘еҲҡзҹігҖҖв‘ўNaBrгҖҖв‘ЈH2SO4гҖҖв‘ӨNa2CO3 в‘ҘNH4ClгҖҖв‘ҰNaHSO4гҖҖ⑧NeгҖҖв‘ЁNa2O2гҖҖв‘©NaOH (1)иҝҷдәӣзү©иҙЁдёӯпјҢеҸӘеҗ«жңүе…ұд»·й”®зҡ„жҳҜ________пјӣеҸӘеҗ«жңүзҰ»еӯҗй”®зҡ„жҳҜ________пјӣж—ўеҗ«жңүе…ұд»·й”®еҸҲеҗ«жңүзҰ»еӯҗй”®зҡ„жҳҜ________пјӣдёҚеӯҳеңЁеҢ–еӯҰй”®зҡ„жҳҜ________гҖӮ (2)еұһдәҺе…ұд»·еҢ–еҗҲзү©зҡ„жҳҜ________пјӣеұһдәҺзҰ»еӯҗеҢ–еҗҲзү©зҡ„жҳҜ________гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
жҹҗеӯҰз”ҹдёәдәҶжҺўз©¶й”ҢдёҺзӣҗй…ёеҸҚеә”иҝҮзЁӢдёӯзҡ„йҖҹзҺҮеҸҳеҢ–пјҢд»–еңЁ100 mLзЁҖзӣҗй…ёдёӯеҠ е…Ҙи¶ійҮҸзҡ„й”ҢзІүпјҢз”ЁжҺ’ж°ҙйӣҶ气法收йӣҶеҸҚеә”ж”ҫеҮәзҡ„ж°ўж°”пјҢе®һйӘҢи®°еҪ•еҰӮдёӢ(зҙҜи®ЎеҖј)пјҡ
в‘ е“ӘдёҖж—¶й—ҙж®ө(жҢҮ0пҪһ1гҖҒ1пҪһ2гҖҒ2пҪһ3гҖҒ3пҪһ4гҖҒ4пҪһ5 min)еҸҚеә”йҖҹзҺҮжңҖеӨ§______пјҢеҺҹеӣ жҳҜ______________гҖӮ в‘Ўе“ӘдёҖж®өж—¶ж®өзҡ„еҸҚеә”йҖҹзҺҮжңҖе°Ҹ___________пјҢеҺҹеӣ жҳҜ_____________________________гҖӮВ В В В В В В В В В В В В В В В В В В В В В В В В в‘ўжұӮ2пҪһ3еҲҶй’ҹж—¶й—ҙж®өд»Ҙзӣҗй…ёзҡ„жө“еәҰеҸҳеҢ–жқҘиЎЁзӨәзҡ„иҜҘеҸҚеә”йҖҹзҺҮ(и®ҫжә¶ж¶ІдҪ“з§ҜдёҚеҸҳ) _____гҖӮ в‘ЈеҰӮжһңеҸҚеә”еӨӘжҝҖзғҲпјҢдёәдәҶеҮҸзј“еҸҚеә”йҖҹзҺҮиҖҢеҸҲдёҚеҮҸе°‘дә§з”ҹж°ўж°”зҡ„йҮҸпјҢд»–еңЁзӣҗй…ёдёӯеҲҶеҲ«еҠ е…ҘзӯүдҪ“з§Ҝзҡ„дёӢеҲ—жә¶ж¶ІпјҡAпјҺи’ёйҰҸж°ҙгҖҒBпјҺNaClжә¶ж¶ІгҖҒCпјҺAgNO3жә¶ж¶ІгҖҒDпјҺCuSO4жә¶ж¶ІгҖҒEпјҺNa2CO3жә¶ж¶ІпјҢдҪ и®ӨдёәеҸҜиЎҢзҡ„жҳҜ___________гҖӮ
|
|||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||
|
жҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„дёәдәҶжҺўз©¶й“қз”өжһҒеңЁеҺҹз”өжұ дёӯзҡ„дҪңз”ЁпјҢи®ҫ计并иҝӣиЎҢдәҶд»ҘдёӢдёҖзі»еҲ—е®һйӘҢпјҢе®һйӘҢз»“жһңи®°еҪ•еҰӮдёӢгҖӮ
иҜ•ж №жҚ®дёҠиЎЁдёӯзҡ„е®һйӘҢзҺ°иұЎеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)е®һйӘҢ1гҖҒ2дёӯAlжүҖдҪңзҡ„з”өжһҒ(жӯЈжһҒжҲ–иҙҹжһҒ)жҳҜеҗҰзӣёеҗҢ(еЎ«вҖңжҳҜвҖқжҲ–вҖңеҗҰвҖқ)пјҹ____________гҖӮ (2)еҜ№е®һйӘҢ3е®ҢжҲҗдёӢеҲ—еЎ«з©әпјҡ в‘ й“қдёә________жһҒпјҢз”өжһҒеҸҚеә”ејҸпјҡ_______________________________________________гҖӮ в‘ЎзҹіеўЁдёә________жһҒпјҢз”өжһҒеҸҚеә”ејҸпјҡ_____________________________________________гҖӮ в‘ўз”өжұ жҖ»еҸҚеә”ејҸпјҡ_____________________________________________________________гҖӮ (3)е®һйӘҢ4дёӯй“қдҪңиҙҹжһҒиҝҳжҳҜжӯЈжһҒ________пјҢзҗҶз”ұжҳҜ__________________гҖӮеҶҷеҮәй“қз”өжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҡ_______________________________________________гҖӮ (4)и§ЈйҮҠе®һйӘҢ5дёӯз”өжөҒиЎЁжҢҮй’ҲеҒҸеҗ‘й“қзҡ„еҺҹеӣ пјҡ ________________________________________________________________________гҖӮ
|
|||||||||||||||||||||||||
- 2018-2019е№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеҶ…и’ҷеҸӨиҮӘжІ»еҢәй”Ұеұұи’ҷеҸӨж—ҸдёӯеӯҰпјү
- 2019е№ҙиҮі2020е№ҙй«ҳдәҢеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·пјҲиҙөе·һзңҒйҒөд№үиҲӘеӨ©й«ҳзә§дёӯеӯҰпјү
- еұұдёңзңҒж»Ёе·һеёӮ2021еұҠй«ҳдёүеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жі°е®үеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еҗүеҢ–第дёҖй«ҳзә§дёӯеӯҰж Ўй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2019-2020е№ҙй«ҳдёҖ10жңҲжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжөҷжұҹзңҒжқӯе·һеёӮиҘҝж№–й«ҳзә§дёӯеӯҰпјү
- 2018иҮі2019е№ҙй«ҳдәҢдёӢжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲжІіеҚ—зңҒе‘ЁеҸЈдёӯиӢұж–ҮеӯҰж Ўпјү
- еЁҒжө·еёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҹдёӯиҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ