2020甘肃高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列说法中,正确的是 A.强电解质溶液一定 B.强电解质的水溶液中不存在溶质分子 C.强电解质都是离子化合物,弱电解质都是共价化合物 D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质
|
|
| 2. | 详细信息 |
|
下列说法或表示不正确的是 A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 B.C(金刚石,s)=C(石墨,s) △H=−1.19kJ·mol−1,所以石墨比金刚石稳定 C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+
|
|
| 3. | 详细信息 |
|
下列有关能量的说法不正确的是 A.化学能可以转变成为热能、电能等 B.应用盖斯定律,可计算某些难以用实验直接测量的反应焓变 C.化学反应中的能量变化主要是由化学键的变化引起的 D.酸碱中和反应放出的能量可设计为原电池转化为电能
|
|
| 4. | 详细信息 |
|
下列说法正确的是 A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 B.反应NH4HCO3(s) C.因为焓变和熵变都与反应的自发性有关,所以焓变和熵变均可以单独作为反应能否自发进行的判据 D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
|
|
| 5. | 详细信息 |
|
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+)下列叙述正确的是 A.电解后,电解槽底部的阳 B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.阳极发生还原反应,其电极反应式:Ni2++2e−=Ni
|
|
| 6. | 详细信息 |
|
已知:2H2(g)+O2(g)=2H2O(l) ΔH=−571.6kJ·mol−1 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=−1452kJ·mol−1 H+(aq)+OH−(aq)=H2O(l) ΔH=−57.3kJ·mol−1 下列说法正确的是 A.H2(g)的燃烧热为571.6kJ·mol−1 B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=−57.3 kJ·mol−1 C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol−1 D.等质量的H2
|
|
| 7. | 详细信息 |
|
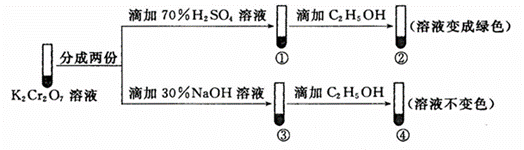
.K2Cr2O7溶液中存在平衡:Cr2O72−(橙色)+H2O
结合实验,下列说法正确的是 A.①中溶液变黄,③中溶液橙色加深 B.②中Cr2O72−被C2H5OH氧化 C.K2Cr2O7在碱性条件下的氧化性比酸性条件更强 D.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
|
|
| 8. | 详细信息 |
|
下列解释事实的方程式不正确的是 A.小苏打溶液呈弱碱性:HCO3−+H2O B.测0.1 mol/L氨水的pH为11:NH3·H2O C.pH=5的硫酸稀释1000倍,pH约等于7:H2O D.用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO32−(aq)
|
|
| 9. | 详细信息 |
|
下列有关说法不正确的是 A.同一物质的固、液、气三种状态的熵值相同 B.自发进行的化学反应的方向,应由焓判据和熵判据的复合判据来判断 C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0 D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
|
|
| 10. | 详细信息 |
|
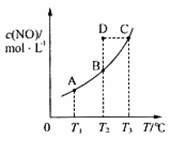
在容积一定的 N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
A.该反应的ΔH>0 B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2 C.在T2℃时,若反应体系处于状态D,则此时v正>v逆 D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
|
|
| 11. | 详细信息 |
|
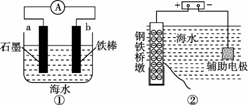
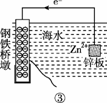
研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是
A.用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 B.②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C.③中采用了牺牲阳极的阴极保护法保护桥墩 D.①②③中海水均是实现化学能与电能相互转化的电解质
|
|
| 12. | 详细信息 |
|
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是
A.右边吸附层中发生了还原反应 B.负极的电极反应是H2-2e−+2OH− C.电池的总反应是2H2+O2 D.电解质溶液中Na+向右移动,ClO4−向左移动
|
|
| 13. | 详细信息 |
|
下图是电解
A.x 电极为阳极,y 电极为阴极 B.x 电极附近溶液变红色,且有刺激性气味气体产生 C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1 D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
|
|
| 14. | 详细信息 |
|
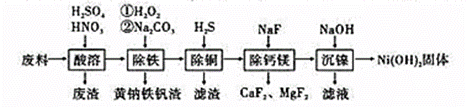
一种废料的主要成分是
A.废渣中含有二氧化硅和硫酸钙 B.加热煮沸可以提高除铁效率 C.除铜过程中,溶液酸性增强 D.“沉镍”过程中为了将镍沉淀完全,需要调节pH>9
|
|
| 15. | 详细信息 |
|
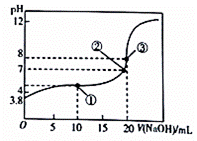
已知HA为一元酸,常温下向20 mL 0.01 mol/L的HA溶液中滴加0.01 mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是
A.常温下,该酸的电离常数K=10−5.6 B.该测定过程中不可以选择甲基橙为指示剂 C.滴定至①处时,溶液中离子浓度关系为:c(A−)>c(Na+)>c(H+)>c(OH−) D.由①到③过程中,水的电离程度先增大后减小
|
|
| 16. | 详细信息 |
|
在2 L的密闭容器中发生反应xA(g)+yB(g)
甲 乙 A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L−1·min−1 B.200 ℃时,该反应的平衡常数为25 C.当温度由200 ℃降到100 ℃,原平衡一定被破坏,且正逆反应速率均增大 D.由图乙可知,反应xA(g)+yB(g)
|
|
| 17. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
已知25℃、101 kPa时某些物质的燃烧热数据如下:
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是_______。 (2)石墨与金刚石互为_______。 A.同位素 B.同素异形体 C.同分异构体 D.同系物 常温常压下,二者更稳定的是______。(填中文名称) (3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为______mol。 (4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=_______。 (5)已知破坏下列化学键需要吸收的能量如下:
根据(4)的结论,估算C−H键的键能为_______kJ/mol。 a.322.5 b.422.5 C.522.5 d.622.5
|
|||||||||||||||||||||||||||||||||||||
| 18. | 详细信息 |
|
(2)已知某溶液中只有Na+、CH3COO−、H+、OH−四种离子。某同学推测该溶液中个离子浓度可能有如下四种系: A.c(Na+)>c(CH3COO−)>c(OH−)>c(H+) B.c(Na+)>c(CH3COO−)>c(H+)>c(OH−) C.c(Na+)>c(OH−)>c(CH3COO−)>c(H+) D.c(CH3COO−)>c(Na+)>c(H+)>c(OH−) ①若溶液中只溶解了一种溶质,该溶质的名称是_________,上述离子浓度大小关系中正确的是(填序号)_____。 ②若上述关系中D是正确的,则溶液中溶质的化学式是________。 ③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同)___________c(NaOH),混合后c(CH3COO−)与c(Na+)的关系是c(CH3COO−)__________c(Na+)。 |
|
| 19. | 详细信息 | ||||||||||||||
|
为了减少温室气体排放,目前工业上采用CO2与H2在CuO−ZnO/ZrO催化下反应制备重要化工原料甲醇(CH3OH)的工艺:CO2(g)+3H2(g)
根据题目回答下列问题: (1)0~3 s内用H2表示的平均反应速率是__________。 (2)平衡时CO2的物质的量为_____________。 (3)能说明反应已达平衡状态的是________ (填序号,双选)。 A.v(H2)=3v(CO2) B.容器内压强保持不变 C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变 (4)为了提高经济效益,下列措施可行的是____________ (填序号,多选)。 A.增大H2浓度,提升CO2的转化率 B.适当升高温度 C.增大CO2浓度 D.选择适当的催化剂
|
|||||||||||||||
| 20. | 详细信息 | ||||||||||||||||
|
Ⅰ.含有弱酸 HA 和其钠盐 NaA 的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。 (1)向该溶液中加入少量盐酸时,发生反应的离子方程式是_____;向其中加入少量KOH溶液时,发生反应的离子方程式是_________。 (2)现将0.04mol·L−1HA 溶液和0.02mol·L−1NaOH 溶液等体积混合,得到缓冲溶液。 ①若 HA为HCN,该溶液显碱性,则溶液中 c(Na+)____c(CN−)(填“<”“=”或“>”)。 ②若 HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是____。 II.(3)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
针对甲、乙、丙三组实验,回答下列问题: ①甲组反应后,溶液中离子浓度的大小顺序为__________________; ②乙组b_____7(填“>”、“<”或“=”); ③丙组溶液混合后c=7,A___0.1mol·L−1(填“>”、“<”或“=”); ④甲中a=6,混合溶液中c(Cl−)−c(NH4+)= ____________mol·L−1 (列式表示结果,不能做近似计算)。
|
|||||||||||||||||
| 21. | 详细信息 |
|
某研究性学习小组将下列装置如图连接,C
(1)电源A极的名称是________。 (2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________ (3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2−、CN−等有明显去除效果,某工厂污水中含CN−,现用ClO2把CN−氧化成两种无毒气体,写出该反应的离子方程式:_____________。 (4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。 (5)装置丁中的现象是_______。
|
|