2018湖北高三上学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
下列有关说法不正确的是( ) A.“凡造竹纸……用上好石灰化汁涂浆”,造纸利用了石灰的碱性 B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C.李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 D.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化
|
|
| 2. | 详细信息 |
|
化学与生产、生活及环境密切相关,下列有关说法正确的是( ) A.酸雨的pH在5.6~7.0之间 B.用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒 C.用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料 D.Al(OH)3 可用于治疗胃酸过多
|
|
| 3. | 详细信息 |
|
下列变化中,气体被氧化的是( ) A.二氧化碳使Na2O2固体变白 B.二氧化硫使KMnO4溶液褪色 C.氯气使FeCl2溶液变黄 D.氨气使MgCl2溶液产生白色沉淀
|
|
| 4. | 详细信息 |
|
下列说法正确的是 ( ) A.液氯是单质,HD是化合物,NO2是酸性氧化物 B.汽油、漂白粉、水玻璃、王水均为混合物 C.煤的气化、液化是物理变化,煤的干馏是化学变化 D.NH3 、NH3·H2O均为电解质,且都为纯净物
|
|
| 5. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法正确的是( ) A.将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA B.100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2 NA 和3 NA C.3molFe在纯氧中完全燃烧转移的电子数为8NA D.已知:N2(g)+3H2(g)
|
|
| 6. | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- B.向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ D.向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应: 4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
|
|
| 7. | 详细信息 |
|
实验室提纯含少量氯化钠杂质的硝酸钾的过程如右图所示,下列分析不正确的是 ( ) A.操作Ⅰ是溶解,将样品溶于适量水中 B.操作Ⅱ是加热蒸发,趁热过滤 C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 D.经过上述操作后的溶液中仍然含有KNO3
|
|
| 8. | 详细信息 |
|
25℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水密度为ρg·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中正确的是 ( ) A.溶液中c(OH-)=( B.溶质的物质的量浓度c= C.溶质的质量分数为ω= D.为使溶液的质量分数等于0.5 ω应加入V mL水
|
|
| 9. | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能一步实现的是( ) A.Fe(过量) B.Si C.Na2CO3 D.NaCl(aq)
|
|
| 10. | 详细信息 |
|
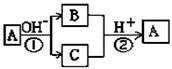
A是中学化学中常见的单质,B、C为化合物,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断不正确的是( ) A.A、B、C一定含有一种相同的元素 B.A可能是金属,也可能是非金属 C.B、C的水溶液可能呈碱性或中性 D.反应①和②一定都是氧化还原反应
|
|
| 11. | 详细信息 |
|
根据如图转化关系判断下列说法不正确的是(反应条件已略去)( )
A.反应①②③④⑤均属于氧化还原反应③④⑤ B.生成黑锰矿的反应中,3 molMn参加反应转移4mol电子 C.生成等量的O2,反应③和④转移的电子数之比为1:2 D.反应⑤为铝热反应
|
|
| 12. | 详细信息 |
|
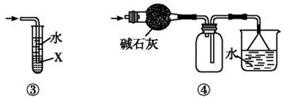
下列有关各实验的叙述中正确的是 ( )
A.①利用CCl4密度大于乙醇,进行CCl4与乙醇混合物的分离 B.②进行H2、NH3、CO2、Cl2、NO、NO2等气体的收集 C.③当X选用苯时可进行NH3或HCl的吸收,并防止倒吸 D.④可用于NH3的干燥,收集并吸收多余NH3
|
|
| 13. | 详细信息 |
|
在相同条件下,将质量均为m的Na、Mg、Al分别加入盛有100mL1mol·L-1稀盐酸的甲、乙、丙三支试管中充分反应,生成气体的体积关系为:甲(Na)>乙(Mg)=丙(Al),则m可能是 ( ) A. 4.0g B. 2.3g C. 1.2g D. 1.8g
|
|
| 14. | 详细信息 |
|
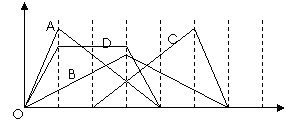
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线正确的是( )
A.A曲线表示向AlCl3溶液中滴入NaOH溶液至过量 B.B曲线表示向NaAlO2溶液中通入CO2至过量 C.C曲线表示向n(HCl):n(AlC13)=1:1的混合溶液中滴入NaOH溶液至过量 D.D曲线表示向n[Ca(OH)2]:n(KOH)=1:2的混合溶液中通入CO2至沉淀消失
|
|
| 15. | 详细信息 |
|
向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是 ( ) A.当 B.当b=a时:溶液的酸性明显增强 C.当 D.当
|
|
| 16. | 详细信息 |
|
某磁黄铁矿的主要成分可看作FexS(S为-2价),既含有Fe2+又含有Fe3+,将一定量的该磁黄铁矿与200mL的盐酸恰好完全反应(注:矿石中其他成分不参与反应),生成4.8g硫单质、0.85molFeCl2和一定量H2S气体,且溶液中无Fe3+,则下列说法不正确的是 ( ) A. 200mL的盐酸中HCl的物质的量浓度为8.5 mol·L-1 B. 生成H2S气体在标准状况下的体积为3.36L C. 该磁黄铁矿FexS中Fe2+与Fe3+的物质的量之比为11:6 D. 该磁黄铁矿中FexS的x等于0.85
|
|
| 17. | 详细信息 |
|
硫酸是一种重要的基础化工原料,常用硫酸的年产量来衡量一个国家的化工生产能力。 I.实验需1.00 mol/L稀硫酸240mL,某同学用98%的浓硫酸(密度为1.84g·cm-3)配制。回答下列问题: (1)应用量筒量取98%的浓硫酸 mL。 (2)在配制上述溶液实验中,下列操作引起结果偏高的有_____ ___。 A.该学生在量取浓硫酸时,仰视刻度线 B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作 C.在烧杯中溶解搅拌时,溅出少量溶液 D.容量瓶中原来存有少量蒸馏水 E.将量筒洗涤2~3次,并全部转移至容量瓶中 II.实验室常用萤石(CaF2)和浓硫酸为原料在铅皿中加热制取氟化氢,用水吸收氟化氢得氢氟酸。 (1)写出该铅皿中发生的化学反应方程式 。 (2)用化学方程式表示不在玻璃器皿中反应的原因 。 (3)不太稀的氢氟酸溶液中,存在2HF
|
|
| 18. | 详细信息 |
|
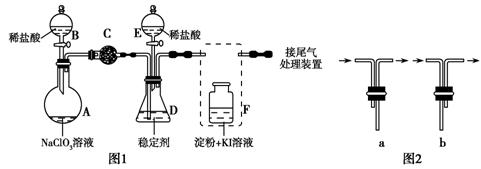
ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
(1)仪器A的名称是 。安装F中导管时,应选用 (2)打开B的活塞,A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为 。 (3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。 (4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。 (5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的浓度,进行了下列实验: 步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样,量取V0 mL试样加入到锥形瓶中; 步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻; 步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。 (已知2ClO2+10I-+8H+=2Cl-+5I2+4H2O 2Na2S2O3+I2═Na2S4O6+2NaI) 计算该ClO2的浓度为 g/L(用含字母的代数式表示,计算结果化简)
|
|
| 19. | 详细信息 |
|
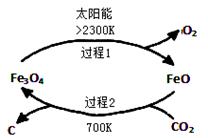
CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但在科学家的眼里,没有废弃的物质。CO2作为一种资源,开发和利用的前景十分诱人。
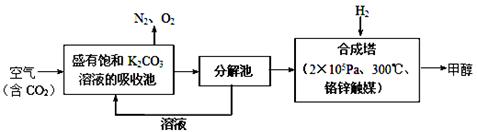
I.利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为 。 II.近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成甲醇。其工艺流程如图所示:
(1)①由吸收池导入分解池中的主要物质的化学式是_______________。 ②上述流程中_______________(填化学式)可循环使用,体现了该流程的“绿色”。 (2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示:
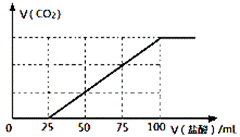
①合成塔中发生的化学反应方程式为 ,T1时a点ʋ(正) ʋ(逆)(填 “>”,“<”,“=” )。 ②计算温度为T5时甲醇的产率为 。 (3)为检验吸收池中饱和K2CO3溶液是否充足,量取100mL吸收液用0.10 mol·L-1盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸) 变化关系如图所示:
则该100mL吸收液还可吸收标准状况下_____________mLCO2
|
|
| 20. | 详细信息 |
|
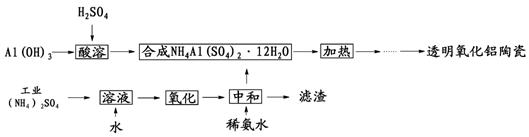
以Al(OH)3、H2SO4、工业硫酸铵(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
回答下列问题: (1)氧化步骤中需加入稍过量的氧化剂,下列物质中最合适的是________。 a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7 (2)选用上述氧化剂氧化之后,需取少量溶液检验Fe2+是否已全部被氧化,所加试剂为 (写名称)。 (3)如何检验中和液中的杂质离子已完全除尽? 。 , 。 (4)固体NH4Al(SO4)2·12H2O(相对分子质量453)在加热时,固体残留率随温度的变化如下图所示。 由300℃加热至633℃时发生反应的化学方程式为 ;(已知该反应为非氧化还原反应) 975℃时剩余固体成分的化学式为 。
|
|
| 21. | 详细信息 |
|
已知100mL某无色溶液X可能由K+、Mg2+、Ba2+、Al3+、Fe2+、AlO I-、SiO Ⅰ.取适量该溶液,加入过量1.0 mol·L-1的硝酸,有气体生成,并得到无色溶液。该过程中产生沉淀的物质的量与加入的硝酸溶液体积的关系如下图所示。
Ⅱ.将Ⅰ过滤,在所得滤液中再加入过量的碳酸氢铵溶液,有气体生成,析出白色沉淀A; Ⅲ.在Ⅱ所得溶液中逐滴加入氢氧化钡溶液至过量,加热有气体生成,同时析出白色沉淀B; IV.向沉淀B中加入过量稀盐酸,沉淀部分溶解,将剩余沉淀过滤、洗涤、干燥后称重为2.33克。 根据以上实验事实推断: (1)原溶液中一定含有的离子是 。 (2)上述实验步骤Ⅱ中产生白色沉淀A的离子方程式是 。 (3)白色沉淀B的成分是 。 (4)原溶液中阳离子物质的量浓度为 。
|
|