2017й»‘йҫҷжұҹй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺеҺҹеӯҗзҡ„еҮ з§ҚжҸҸиҝ°дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В В В пјү A. 15пј®дёҺ14пј®е…·жңүзӣёеҗҢзҡ„иҙЁеӯҗж•°В В В B. 12пјЈдёҺ13пјЈе…·жңүзӣёеҗҢзҡ„иҙЁйҮҸж•° C. 16пјҜдёҺ17пјҜе…·жңүзӣёеҗҢзҡ„з”өеӯҗж•°В В В D. 18пјҜдёҺ19пјҰе…·жңүзӣёеҗҢзҡ„дёӯеӯҗж•°
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
AпјҢBдёӨе…ғдёәжҹҗе‘Ёжңҹв…ЎAж—Ҹе’Ңв…ўAж—Ҹе…ғзҙ пјҢиӢҘAзҡ„еҺҹеӯҗеәҸж•°дёәxпјҢеҲҷBзҡ„еҺҹеӯҗеәҸж•°еҸҜиғҪжҳҜпјҲВ В В В В пјү в‘ x+1В в‘Ўx+81В в‘ўx+11В в‘Јx+18В В в‘Өx+25 A. в‘ в‘ўВ В В B. в‘Ўв‘ЈВ В В C. в‘Ўв‘ўв‘Јв‘ӨВ В В D. в‘ в‘ўв‘Ө
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ пјҲВ В В пјү A. д№ҷзғҜе’ҢиӢҜйғҪеҸҜд»ҘдҪҝжәҙж°ҙиӨӘиүІ B. д№ҷзғҜеҸҜд»ҘдёҺж°ўж°”еҸ‘з”ҹеҠ жҲҗеҸҚеә”пјҢиӢҜдёҚиғҪдёҺж°ўж°”еҠ жҲҗ C. з”Ізғ·е’Ңд№ҷзғҜйғҪеҸҜд»ҘдёҺж°Ҝж°”еҸҚеә” D. ж¶ІеҢ–зҹіжІ№ж°”е’ҢеӨ©з„¶ж°”зҡ„дё»иҰҒжҲҗеҲҶйғҪжҳҜз”Ізғ·
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
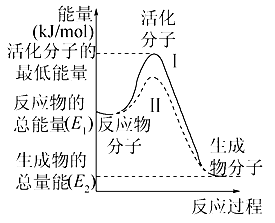
е·ІзҹҘN2+3H2 A. N2зҡ„иғҪйҮҸдёҖе®ҡй«ҳдәҺNH3 B. H2зҡ„иғҪйҮҸдёҖе®ҡй«ҳдәҺNH3 C. 1 mol N2е’Ң3 mol H2зҡ„жҖ»иғҪйҮҸдёҖе®ҡй«ҳдәҺ2 mol NH3зҡ„жҖ»иғҪйҮҸ D. еӣ иҜҘеҸҚеә”дёәж”ҫзғӯеҸҚеә”пјҢж•…дёҚеҝ…еҠ зғӯе°ұеҸҜеҸ‘з”ҹ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. еҺҹз”өжұ зҡ„иҙҹжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә” B. еҢ–еӯҰй”®еҪўжҲҗзҡ„иҝҮзЁӢйңҖиҰҒеҗёж”¶зғӯйҮҸ C. еҺҹз”өжұ зҡ„жӯЈжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә” D. еҢ–еӯҰй”®зҡ„ж–ӯиЈӮиҝҮзЁӢдёӯж”ҫеҮәзғӯйҮҸ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„е…ғзҙ зҡ„еҺҹеӯҗйҡҸзқҖеҺҹеӯҗеәҸж•°зҡ„йҖ’еўһпјҢжңүе…ійҖ’еҸҳе…ізі»дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ пјү A. еҺҹеӯҗеҚҠеҫ„пјҡSi > P > S > ClВ В В B. йҮ‘еұһжҖ§пјҡNa < K < Rb < Cs C. жңҖй«ҳжӯЈд»·пјҡC < N < O <FВ В В D. йқһйҮ‘еұһжҖ§пјҡ P < S < Cl
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В й“ңзүҮе’Ңй”ҢзүҮз”ЁеҜјзәҝиҝһжҺҘеҗҺжҸ’е…ҘзЁҖH2SO4дёӯпјҢй”ҢзүҮжҳҜпјҲВ В В В В пјү A. йҳҙжһҒВ В В B. иҙҹжһҒВ В В C. йҳіжһҒВ В В D. жӯЈжһҒ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҸҚеә”2SO2+ O2 A. 0.1sВ В В B. 2.5sВ В В C. 10sВ В В D. 5s
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲҶеӯҗзҡ„з©әй—ҙжһ„еһӢдёәжӯЈеӣӣйқўдҪ“зҡ„жҳҜ(В В В ) A. иӢҜВ В В B. з”Ізғ· C. д№ҷзғ·В В В D. д№ҷзғҜ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
В вҖңйҳҝжіўзҪ—еҸ·йЈһиҲ№вҖқжүҖз”Ёзҡ„ж°ўж°§зҮғж–ҷз”өжұ зҡ„з”өжһҒеә”дёәпјҡиҙҹжһҒпјҡ2H2пјӢ4OHпјҚпјҚ4eпјҚпјқ4H2OпјҢжӯЈжһҒ O2пјӢ2H2OпјӢ4eпјҚпјқ4OHпјҚиҜҘз”өжұ е·ҘдҪңж—¶пјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. ж°ўж°”еҸ‘з”ҹиҝҳеҺҹеҸҚеә” B. жҜҸиҪ¬з§»4ж‘©з”өеӯҗпјҢз”өжұ еҶ…еўһеҠ 4ж‘©ж°ҙ C. жӯЈжһҒйҷ„иҝ‘c(H+)еўһеӨ§ D. иҙҹжһҒйҷ„иҝ‘жә¶ж¶Ізҡ„PHеҖјйҷҚдҪҺ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҸҚеә”ж—ўжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҸҲжҳҜеҗёзғӯеҸҚеә”зҡ„жҳҜВ В В пјҲВ В В пјү A. зҒјзғӯзҡ„зӮӯдёҺCO2еҸҚеә”В В В B. Ba(OH)2В·8H2OдёҺNH4Clзҡ„еҸҚеә” C. й“қзүҮдёҺзЁҖзЎ«й…ёеҸҚеә”В В В D. з”Ізғ·еңЁO2дёӯзҮғзғ§еҸҚеә”
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҸҜйҖҶеҸҚеә”H2(g) пјӢ I2(g) A. H2гҖҒI2гҖҒHIзҡ„жө“еәҰзӣёзӯүВ В В B. ж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ C. H2гҖҒI2гҖҒHIзҡ„жө“еәҰдҝқжҢҒдёҚеҸҳВ В В D. ж··еҗҲж°”дҪ“зҡ„иҙЁйҮҸдёҚеҶҚж”№еҸҳ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. S(s)+O2(g)==SO2(g)В в–іH=пјҚ296.8kl/molпјҲеҸҚеә”зғӯпјү B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)В в–іH=+57.3kl/molпјҲдёӯе’Ңзғӯпјү C. C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g)В в–іH=пјҚ1367.0kl/molпјҲзҮғзғ§зғӯпјү D. 2NO2==O2+2NOВ в–іH=+116.2kl/molпјҲеҸҚеә”зғӯпјү
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A. жә¶дәҺж°ҙиғҪеҜјз”өзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү© B. еңЁе…ұд»·еҢ–еҗҲзү©дёӯдёҖе®ҡеҗ«жңүе…ұд»·й”® C. еҗ«жңүе…ұд»·й”®зҡ„еҢ–еҗҲзү©дёҚдёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү© D. зҰ»еӯҗеҢ–еҗҲзү©дёӯдёҚдёҖе®ҡйғҪеҗ«жңүйҮ‘еұһе…ғзҙ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—иЈ…зҪ®дёӯпјҢз”өжөҒи®ЎGдёӯжңүз”өжөҒйҖҡиҝҮзҡ„жҳҜпјҲВ В В пјү
A. AВ В В B. BВ В В C. CВ В В D. D
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ЁйғЁеЎ«е…ғзҙ з¬ҰеҸ·жҲ–еҢ–еӯҰејҸ)11вҖ”18еҸ·е…ғзҙ дёӯпјҢеҢ–еӯҰжҖ§иҙЁжңҖзЁіе®ҡзҡ„е…ғзҙ жҳҜ____пјӣжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–й…ёжҖ§жңҖејәзҡ„е…ғзҙ жҳҜ_______пјӣжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©дёәдёӨжҖ§ж°ўж°§еҢ–зү©пјҢе…¶еҢ–еӯҰејҸдёә__________пјӣдёҺй…ёжҲ–ж°ҙеҸҚеә”зҪ®жҚўж°ўиғҪеҠӣжңҖејәзҡ„е…ғзҙ жҳҜ____пјҢе…¶жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„еҢ–еӯҰејҸдёә_______гҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||
|
В еҜ№дәҺеҸҚеә”пјҡ2SO2пјӢO2
|
||||||||||||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲдёҖпјүиҜ·и®Өзңҹи§ӮеҜҹдёӢеӣҫпјҢ然еҗҺеӣһзӯ”й—®йўҳгҖӮ
еӣҫдёӯжүҖзӨәеҸҚеә”жҳҜ__________(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”пјҢиҜҘеҸҚеә”зҡ„О”Hпјқ__________(з”Ёеҗ«E1гҖҒE2зҡ„д»Јж•°ејҸиЎЁзӨә)гҖӮ пјҲдәҢпјүе·ІзҹҘдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ в‘ H2(g)пјӢO2(g)===H2O(l)гҖҖО”HпјқпјҚ285.8 kJ/mol в‘ЎH2(g)пјӢO2(g)===H2O(g)гҖҖО”HпјқпјҚ241.8 kJ/mol в‘ўC(s)пјӢO2(g)===CO(g)гҖҖО”HпјқпјҚ110.5 kJ/mol в‘ЈC(s)пјӢO2(g)===CO2(g)гҖҖО”HпјқпјҚ393.5 kJ/mol еӣһзӯ”дёӢеҲ—еҗ„й—®йўҳпјҡ (1)H2зҡ„зҮғзғ§зғӯдёә__________пјӣCзҡ„зҮғзғ§зғӯдёә________гҖӮ (2)дёҠиҝ°еҸҚеә”дёӯеұһдәҺж”ҫзғӯеҸҚеә”зҡ„жҳҜ__________________гҖӮпјҲеЎ«еәҸеҸ·пјү
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
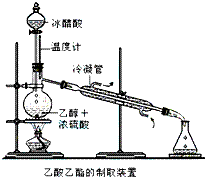
В е®һйӘҢе®ӨеҗҲжҲҗд№ҷй…ёд№ҷй…Ҝзҡ„жӯҘйӘӨеҰӮдёӢпјҡеңЁеңҶеә•зғ§з“¶еҶ…еҠ е…Ҙд№ҷйҶҮгҖҒжө“зЎ«й…ёе’Ңд№ҷй…ёпјҢ瓶еҸЈз«–зӣҙе®үиЈ…йҖҡжңүеҶ·еҚҙж°ҙзҡ„еҶ·еҮқз®ЎпјҲдҪҝеҸҚеә”ж··еҗҲзү©зҡ„и’ёж°”еҶ·еҮқдёәж¶ІдҪ“жөҒеӣһзғ§з“¶еҶ…пјүпјҢеҠ зғӯеӣһжөҒдёҖж®өж—¶й—ҙеҗҺжҚўжҲҗи’ёйҰҸиЈ…зҪ®иҝӣиЎҢи’ёйҰҸпјҲеҰӮдёӢеӣҫжүҖзӨәпјүпјҢеҫ—еҲ°еҗ«жңүд№ҷйҶҮгҖҒд№ҷй…ёе’Ңж°ҙзҡ„д№ҷй…ёд№ҷй…ҜзІ—дә§е“ҒгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲе·ІзҹҘпјҡд№ҷйҶҮгҖҒд№ҷй…ёгҖҒд№ҷй…ёд№ҷй…Ҝзҡ„жІёзӮ№дҫқж¬ЎжҳҜ78.4в„ғгҖҒ118в„ғгҖҒ77.1в„ғпјү (1)еңЁзғ§з“¶дёӯйҷӨдәҶеҠ е…Ҙд№ҷйҶҮгҖҒжө“зЎ«й…ёе’Ңд№ҷй…ёеӨ–пјҢиҝҳеә”ж”ҫе…ҘеҮ еқ—зўҺз“·зүҮпјҢе…¶зӣ®зҡ„жҳҜ_____________гҖӮ (2)й”ҘеҪўз“¶дёӯеә”еҠ е…Ҙе“Әз§ҚиҜ•еүӮ?________________пјҢдҪңз”ЁжҳҜ__________гҖӮ (3)еҶҷеҮәеҲ¶еҸ–д№ҷй…ёд№ҷй…Ҝзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_____________гҖӮ
|
|
- жЈ ж№–дёӯеӯҰ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеӯҰжңҹејҖеӯҰиҖғиҜ•еңЁзәҝеҒҡйўҳ
- жөҷжұҹй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеҚҠжңҹжңҹжң«иҖғиҜ•е…Қиҙ№иҜ•еҚ·
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№
- иҘҝе®үдёӯеӯҰй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- 2019-2020е№ҙй«ҳдәҢ12жңҲзҙ иҙЁжЈҖжөӢеҢ–еӯҰиҜ•еҚ·пјҲе®үеҫҪеҚ“и¶ҠеҺҝдёӯиҒ”зӣҹпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲж№–еҢ—зңҒе®ңжҳҢеёӮ第дәҢдёӯеӯҰпјү
- йҮҚеәҶеёӮеҮӨйёЈеұұдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҶҢ10жңҲжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е®ңжҳҘеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҖғйўҳеҗҢжӯҘи®ӯз»ғ