2018иҙөе·һй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—д»ӘеҷЁдёӯпјҢдёҚиғҪз”ЁдәҺеҠ зғӯзҡ„жҳҜ A. еқ©еҹҡВ В В B. йҮҸзӯ’В В В C. зғ§жқҜВ В В D. иҜ•з®Ў
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В д»ҘдёӢжҳҜдёҖдәӣеёёз”Ёзҡ„еҚұйҷ©е“Ғж Үеҝ—пјҢиЈ…иҝҗд№ҷйҶҮзҡ„еҢ…иЈ…з®ұеә”иҙҙзҡ„еӣҫж ҮжҳҜ A.
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…іе®һйӘҢе®ӨдёҖиҲ¬дәӢж•…зҡ„йў„йҳІе’ҢеӨ„зҗҶж–№жі•жӯЈзЎ®зҡ„жҳҜ A. зҮғзқҖзҡ„й…’зІҫзҒҜжү“зҝ»еӨұзҒ«пјҢеә”з«ӢеҚіз”Ёж°ҙжөҮзҒӯ B. зҡ®иӮӨдёҠжІҫжңүе°‘йҮҸжө“зЎ«й…ёпјҢеҸҜз«ӢеҚіз”ЁNaOHеҶІжҙ—гҖӮ C. е°‘йҮҸй…ёжҲ–зўұж»ҙеҲ°е®һйӘҢеҸ°дёҠпјҢз«ӢеҚіз”Ёж№ҝжҠ№еёғж“ҰеҮҖпјҢеҶҚз”Ёж°ҙеҶІжҙ—жҠ№еёғ D. и’ёеҸ‘йЈҹзӣҗжә¶ж¶Іж—¶пјҢеҸ‘з”ҹж¶Іж»ҙйЈһжә…зҺ°иұЎпјҢеә”з«ӢеҚіеҠ ж°ҙеҶ·еҚҙ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
ж¬ІйҷӨеҺ»дёӢеҲ—зү©иҙЁдёӯзҡ„жқӮиҙЁпјҲжӢ¬еҸ·еҶ…зү©иҙЁдёәжқӮиҙЁпјүпјҢжүҖз”ЁиҜ•еүӮдёҚжӯЈзЎ®зҡ„жҳҜ A. NaNO3жә¶ж¶ІпјҲNa2SO4пјүпјҡйҖӮйҮҸBaпјҲNO3пјү2жә¶ж¶ІВ В В B. CO2пјҲCOпјүпјҡзҒјзғӯзҡ„ж°§еҢ–й“ң C. CuзІүпјҲZnзІүпјүпјҡиҝҮйҮҸзӣҗй…ёВ В В D. CaCO3зІүжң«пјҲCaCl2пјүпјҡиҝҮйҮҸзӣҗй…ё
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗжЈҖйӘҢзҡ„ж–№жі•жӯЈзЎ®зҡ„жҳҜ A. жҹҗжә¶ж¶ІдёӯеҠ зЎқ酸银жә¶ж¶Із”ҹжҲҗзҷҪиүІжІүж·ҖпјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯжңүClп№Ј B. жҹҗжә¶ж¶ІдёӯеҠ Ba(OH)2жә¶ж¶Із”ҹжҲҗи“қиүІжІүж·ҖпјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯжңүCu2+ C. жҹҗжә¶ж¶ІдёӯеҠ BaCl2жә¶ж¶Із”ҹжҲҗзҷҪиүІжІүж·ҖпјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯжңүSO42п№Ј D. жҹҗжә¶ж¶ІдёӯеҠ зЁҖзЎ«й…ёжә¶ж¶Ідә§з”ҹж— иүІж°”дҪ“пјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯжңүCO32п№Ј
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е®һйӘҢж“ҚдҪңдёӯжңүй”ҷиҜҜзҡ„жҳҜ A. еҲҶж¶Іж—¶пјҢеҲҶж¶ІжјҸж–—дёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәпјҢдёҠеұӮж¶ІдҪ“д»ҺдёҠеҸЈеҖ’еҮә B. е®һйӘҢе®ӨеҲ¶еҸ–и’ёйҰҸж°ҙзҡ„иЈ…зҪ®дёӯпјҢжё©еәҰи®Ўж°ҙ银зҗғеә”дёҺи’ёйҰҸзғ§з“¶зҡ„ж”Ҝз®ЎеҸЈеңЁеҗҢдёҖж°ҙе№ізәҝ C. з”Ёж·ҳжҙ—зҡ„ж–№жі•д»ҺжІҷйҮҢж·ҳйҮ‘ D. з”Ёи’ёеҸ‘ж–№жі•дҪҝNaClд»Һжә¶ж¶ІдёӯжһҗеҮәж—¶пјҢеә”иҫ№еҠ зғӯиҫ№жҗ…жӢҢзӣҙиҮіжә¶ж¶Іи’ёе№І
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. 1 mol H2Oзҡ„иҙЁйҮҸдёә18g/molВ В В B. C2H5OHзҡ„ж‘©е°”иҙЁйҮҸдёә46g C. 3.01Г—1023дёӘSO2еҲҶеӯҗзҡ„иҙЁйҮҸдёә32gВ В В D. ж‘©е°”жҳҜеӣҪйҷ…еҚ•дҪҚеҲ¶дёӯзҡ„дёҖдёӘеҹәжң¬зү©зҗҶйҮҸ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
В е·ұзҹҘдёҷй…®пјҲC3H6Oпјүж— иүІж¶ІдҪ“пјҢеҸҜжә¶дәҺж°ҙпјҢеҜҶеәҰе°ҸдәҺ1 g/mLпјҢжІёзӮ№зәҰдёә56в„ғпјҢиҰҒд»Һж°ҙеҹҹдёҷй…®зҡ„ж··еҗҲзү©йҮҢе°Ҷдёҷй…®еҲҶзҰ»еҮәжқҘпјҢдёӢеҲ—ж–№жі•жңҖеҗҲзҗҶзҡ„жҳҜ A. и’ёйҰҸВ В В B. еҚҮеҚҺВ В В C. иҝҮж»ӨВ В В D. и’ёеҸ‘
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
. NAд»ЈиЎЁйҳҝдјҸдјҪеҫ·зҪ—еёёж•°пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. еңЁеҗҢжё©еҗҢеҺӢдёӢпјҢзӣёеҗҢдҪ“з§Ҝзҡ„д»»дҪ•ж°”дҪ“еҚ•иҙЁжүҖеҗ«зҡ„еҺҹеӯҗж•°зӣ®зӣёеҗҢ B. 2 g H2жүҖеҗ«еҺҹеӯҗж•°зӣ®дёәNA C. 11.2L N2жүҖеҗ«еҺҹеӯҗж•°зӣ®дёҖе®ҡдёәNA D. 5.6gй“ҒдёҺи¶ійҮҸзӣҗй…ёеҸҚеә”еӨұеҺ»з”өеӯҗж•°дёә0.2NA
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
В иҝҮж»ӨеҗҺзҡ„йЈҹзӣҗж°ҙд»Қеҗ«жңүеҸҜжә¶жҖ§зҡ„CaCl2гҖҒMgCl2гҖҒNa2SO4 зӯүжқӮиҙЁпјҢйҖҡиҝҮеҰӮдёӢеҮ дёӘе®һйӘҢжӯҘйӘӨпјҢеҸҜеҲ¶еҫ—зәҜеҮҖзҡ„йЈҹзӣҗж°ҙпјҡв‘ еҠ е…ҘзЁҚиҝҮйҮҸзҡ„Na2CO3жә¶ж¶Іпјӣв‘ЎеҠ е…ҘзЁҚиҝҮйҮҸзҡ„NaOHжә¶ ж¶Іпјӣ в‘ўеҠ е…ҘзЁҚиҝҮйҮҸзҡ„BaCl2жә¶ж¶Іпјӣв‘Јж»ҙе…ҘйҖӮйҮҸзҡ„зЁҖзӣҗй…ёпјӣв‘ӨиҝҮж»ӨпјҺжӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸжҳҜ A. в‘Ўв‘ўв‘ в‘Өв‘ЈВ В В B. в‘ в‘Ўв‘ўв‘Өв‘Ј C. в‘Ўв‘ўв‘ в‘Јв‘ӨВ В В D. в‘ўв‘Өв‘Ўв‘ в‘Ј
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
иҝӣиЎҢиҝҮж»Өж“ҚдҪңеә”йҖүз”Ёзҡ„дёҖз»„д»ӘеҷЁжҳҜ A. зғ§жқҜгҖҒй…’зІҫзҒҜгҖҒиҜ•з®ЎгҖҒй“Ғжһ¶еҸ°пјҲй“ҒеңҲпјүгҖҒжјҸж–— B. ж»ӨзәёгҖҒзғ§жқҜгҖҒиҜ•з®ЎеӨ№гҖҒжјҸж–—гҖҒзҺ»з’ғжЈ’ C. зғ§жқҜгҖҒжјҸж–—гҖҒзҺ»з’ғжЈ’гҖҒй“Ғжһ¶еҸ°пјҲй“ҒеңҲпјүгҖҒж»Өзәё D. ж»ӨзәёгҖҒиҜ•з®ЎгҖҒжјҸж–—гҖҒй“Ғжһ¶еҸ°пјҲй“ҒеңҲпјүгҖҒзҺ»з’ғжЈ’
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
В жҹҗжә¶ж¶Ідёӯеҗ«жңүCO32-гҖҒSO42-гҖҒ NH4+е’ҢMзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ2пјҡ4пјҡ2,еҲҷзҰ»еӯҗMеҸҜиғҪжҳҜ A. H+
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸӘз”ЁдёҖз§ҚиҜ•еүӮе°ұиғҪе°ҶNaClгҖҒBaCl2гҖҒKOHдёүз§Қж— иүІжә¶ж¶ІеҢәеҲ«ејҖпјҢжӯӨиҜ•еүӮжҳҜ A. Na2CO3В В В B. зӣҗй…ёВ В В C. Fe2(SO4)3жә¶ж¶ІВ В В В В D .зЎ«й…ё
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…і0.1 molВ·LпјҚ1гҖҖNaOHжә¶ж¶Ізҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. 1LиҜҘжә¶ж¶Ідёӯеҗ«жңүNaOH 40g B. 100 mLиҜҘжә¶ж¶Ідёӯеҗ«жңүOH-В 0.01mol C. д»Һ1LиҜҘжә¶ж¶ІдёӯеҸ–еҮә100mLпјҢжүҖеҸ–еҮәзҡ„NaOHжә¶ж¶Ізҡ„жө“еәҰдёә0.01 molВ·LпјҚ1 D. еңЁ1 Lж°ҙдёӯжә¶и§Ј4g NaOHеҚіеҸҜй…ҚеҲ¶еҫ—0.1 molВ·LпјҚ1 NaOHжә¶ж¶І
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ1molд»»дҪ•зү©иҙЁдҪ“з§ҜеқҮдёә22.4пј¬ B. 1NAдёӘж°ўж°”еҲҶеӯҗжүҖеҚ зҡ„дҪ“з§Ҝдёә22.4 L C. еҸӘжңүеңЁж ҮеҮҶзҠ¶еҶөдёӢVm=22.4 L/ mol D. ж ҮеҮҶзҠ¶еҶөдёӢ,28g COжүҖеҚ зҡ„дҪ“з§Ҝдёә22.4 L
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
. д»ҘдёӢжҳҜй…ҚеҲ¶250mL0.2molВ·L-1ж°ҜеҢ–й’ жә¶ж¶Ізҡ„жӯҘйӘӨпјҡ в‘ жә¶и§Јв‘Ўжҙ—ж¶Ө③移液④计算в‘Өе®ҡе®№в‘Ҙз§°йҮҸв‘Ұзӣ–еҘҪ瓶еЎһпјҢеҸҚеӨҚдёҠдёӢйў еҖ’пјҢж‘ҮеҢҖгҖӮиҜ·дҪ йҖүеҮәиҜҘжә¶ж¶Ій…ҚеҲ¶зҡ„ж“ҚдҪңе…ҲеҗҺйЎәеәҸжҳҜ A. в‘Ўв‘ўв‘Өв‘ в‘Ҙв‘Ұв‘ЈВ В В B. в‘Јв‘Ҙв‘ в‘ўв‘Ўв‘Өв‘Ұ C. в‘Јв‘Ўв‘Өв‘Ҙв‘ в‘ўв‘ҰВ В В D. в‘Ўв‘Ҙв‘Ұв‘Јв‘ўв‘Өв‘
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
. еңЁ100 mLзҡ„жә¶ж¶Ідёӯжңү0.1 mol NaClе’Ң0.1 mol MgCl2пјҢжӯӨжә¶ж¶ІдёӯCl-зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә A. 0.2molВ·LпјҚ1В В В B. 0.3 molВ·LпјҚ1 C. 2 molВ·LпјҚ1В В В D. 3 molВ·LпјҚ1
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҗ„з»„дёӯзҡ„дёӨз§Қж°”дҪ“зҡ„еҲҶеӯҗж•°дёҖе®ҡзӣёеҗҢзҡ„жҳҜ A. иҙЁйҮҸзӣёзӯүзҡ„COе’ҢC2H4В В В B. зӯүжё©гҖҒзӯүдҪ“з§Ҝзҡ„N2е’ҢCH4 C. дҪ“з§ҜзӣёеҗҢзҡ„N2е’ҢO3В В В D. зӯүеҺӢгҖҒзӯүдҪ“з§ҜN2е’ҢCO2
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
зӯүдҪ“з§Ҝзҡ„зЎ«й…ёй“қгҖҒзЎ«й…ёй”ҢгҖҒзЎ«й…ёй’ жә¶ж¶ІеҲҶеҲ«дёҺи¶ійҮҸж°ҜеҢ–й’Ўжә¶ж¶ІеҸҚеә”пјҢиӢҘз”ҹжҲҗзЎ«й…ёй’ЎжІүж·Җзҡ„иҙЁйҮҸжҜ”дёә2вҲ¶2вҲ¶3пјҢеҲҷдёүз§ҚзЎ«й…ёзӣҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰд№ӢжҜ”дёә A. 1вҲ¶2вҲ¶3В В В B. 2вҲ¶2вҲ¶3В В В C. 3вҲ¶2вҲ¶2В В В D. 2вҲ¶6вҲ¶9
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
зӯүиҙЁйҮҸзҡ„дёӢеҲ—зү©иҙЁжүҖеҗ«еҲҶеӯҗж•°жңҖеӨҡзҡ„жҳҜ A. H2В В В B. SO2В В В C. N2В В В D. CO2
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүеҗ«жңү3.01Г—1023дёӘHзҡ„H2OпјҢе…¶H2Oзү©иҙЁзҡ„йҮҸжҳҜ________пјӣе…¶H2Oдёӯеҗ«жңүз”өеӯҗзҡ„дёӘж•°дёә______________гҖӮ пјҲ2пјү______mol H2Oдёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёҺ1.5 mol CO2дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣёзӯүгҖӮ пјҲ3пјүе°Ҷзӯүзү©иҙЁзҡ„йҮҸзҡ„NH3е’ҢCH4ж··еҗҲпјҢж··еҗҲж°”дҪ“дёӯNH3дёҺCH4зҡ„иҙЁйҮҸжҜ”дёә________гҖӮ пјҲ4пјүиҰҒдҪҝNH3дёҺCH4еҗ«зӣёеҗҢж•°зӣ®зҡ„HеҺҹеӯҗпјҢеҲҷNH3е’ҢCH4зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә__________гҖӮ пјҲ5пјүж ҮеҮҶзҠ¶еҶөдёӢпјҢеҜҶеәҰдёә0.75 gВ·LпјҚ1зҡ„NH3дёҺCH4з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯпјҢNH3зҡ„дҪ“з§ҜеҲҶж•°дёә__________пјҢ(жіЁ:дҪ“з§ҜеҲҶж•°еҚідёәзү©иҙЁзҡ„йҮҸеҲҶж•°пјү пјҲ6пјүе·ІзҹҘa g Aе’Ңb g BжҒ°еҘҪе®Ңе…ЁеҸҚеә”з”ҹжҲҗ0.4mol Cе’Ңd g DпјҢеҲҷCзҡ„ж‘©е°”иҙЁйҮҸдёә________ пјҲ7пјүеҗҢжё©гҖҒеҗҢеҺӢдёӢзӯүиҙЁйҮҸзҡ„SO2ж°”дҪ“е’ҢCO2ж°”дҪ“пјҢдҪ“з§Ҝд№ӢжҜ”___________пјҢеҺҹеӯҗж•°зӣ®д№ӢжҜ”дёә___________пјҢеҜҶеәҰжҜ”дёә___________пјҢж°§е…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә__________гҖӮ пјҲ8пјүжҹҗж°”жҖҒж°§еҢ–зү©еҢ–еӯҰејҸдёәRO2пјҢеңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ1.28gиҜҘж°§еҢ–зү©зҡ„дҪ“з§Ҝдёә448mLпјҢеҲҷиҜҘж°§еҢ–зү©зҡ„ж‘©е°”иҙЁйҮҸдёә____________пјӣRзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёә_____________гҖӮ пјҲ9пјү200mLгҖҒ2.0mol/Lзҡ„Al2пјҲSO4пјү3жә¶ж¶Ідёӯеҗ«Al3+зҡ„зү©иҙЁзҡ„йҮҸдёә___________пјӣд»ҺдёӯеҸ–еҮә10mLпјҢе°Ҷиҝҷ10mLжә¶ж¶Із”Ёж°ҙзЁҖйҮҠеҲ°50mLпјҢжүҖеҫ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә______________гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
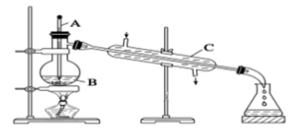
IгҖҒеңЁиҝӣиЎҢеҲҶж¶Іж“ҚдҪңе®һйӘҢж—¶йңҖз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁжҳҜзғ§жқҜе’Ң___________пјҢеңЁиҝӣиЎҢеҲҶж¶Іж—¶пјҢйҰ–е…ҲиҰҒеҜ№е…¶иҝӣиЎҢ____________пјҢе·ІзҹҘиӢҜдёҺCCl4зұ»дјјпјҢеҸҜз”ЁдҪңиҗғеҸ–зўҳж°ҙдёӯзҡ„зўҳпјҢе…¶еҜҶеәҰдёә0.875 g/mLпјҢзҺ°з”Ёе…¶иҗғеҸ–зўҳж°ҙдёӯзҡ„зўҳпјҢжҢҜиҚЎеҗҺе…¶дёҠеұӮдёә_____________иүІгҖӮ IIгҖҒдёӢеӣҫдёәе®һйӘҢе®ӨеҲ¶еҸ–и’ёйҰҸж°ҙзҡ„иЈ…зҪ®зӨәж„ҸеӣҫпјҢж №жҚ®еӣҫзӨәеӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ
пјҲlпјүеӣҫдёӯжңүдёӨеӨ„жҳҺжҳҫзҡ„й”ҷиҜҜжҳҜпјҡв‘ __________пјӣв‘Ў___________гҖӮ пјҲ2пјүBд»ӘеҷЁзҡ„еҗҚз§°жҳҜ__________пјӣCд»ӘеҷЁзҡ„еҗҚз§°жҳҜ_____________гҖӮ пјҲ3пјүе®һйӘҢж—¶BдёӯйҷӨеҠ е…Ҙе°‘йҮҸиҮӘжқҘж°ҙеӨ–пјҢиҝҳйңҖиҰҒеҠ е…Ҙе°‘йҮҸзҡ„____________гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёжө“еәҰдёә18.4molпјҸLжө“H2SO4жә¶ж¶ІжқҘй…ҚеҲ¶2.0molпјҸLзЁҖH2SO4 250mLпјҢж“ҚдҪңжӯҘйӘӨзңҒз•ҘпјҢиҜ·еЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ пјҲ1пјүйңҖйҮҸеҸ–жө“H2SO4зҡ„дҪ“з§Ҝдёә______________mLгҖӮ пјҲ2пјүжүҖйңҖд»ӘеҷЁдёәпјҡ_____________пјӣ пјҲ3пјүиҜ•еҲҶжһҗдёӢеҲ—ж“ҚдҪңеҜ№жүҖй…Қжә¶ж¶Ізҡ„жө“еәҰжңүдҪ•еҪұе“ҚгҖӮпјҲеЎ«вҖңеҒҸй«ҳвҖқвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјү a. еңЁзғ§жқҜдёӯзЁҖйҮҠеҗҺжңӘйҷҚиҮіе®Өжё©ж—¶пјҢз«ӢеҚіе°Ҷжә¶ж¶ІиҪ¬з§»иҮіе®№йҮҸ瓶е®ҡе®№гҖӮеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қ_____гҖӮ b. е®ҡе®№еҗҺпјҢеҠ зӣ–еҖ’иҪ¬ж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢеҸҲж»ҙеҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰгҖӮеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қпјҡ__________гҖӮ c. е®ҡе®№ж—¶дҝҜи§Ҷж¶ІйқўпјҢеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰе°ҶжңүдҪ•еҪұе“Қпјҡ____________
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
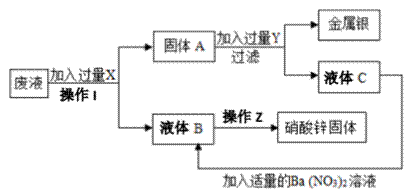
В жҹҗеҺӮжҺ’еҮәзҡ„еәҹж¶Ідё»иҰҒеҗ«Zn(NO3)2е’ҢAgNO3пјҢдёәдәҶд»Һдёӯеӣһ收йҮ‘еұһ银е’ҢзЎқй…ёй”ҢпјҢжҹҗдёӯеӯҰеҢ–еӯҰиҜҫеӨ–жҙ»еҠЁе°Ҹз»„и®ҫи®ЎдәҶд»ҘдёӢзҡ„е®һйӘҢжӯҘйӘӨ
пјҲ1пјүж“ҚдҪңI________ (еҗҚз§°) пјҲ2пјүж»Өж¶ІBзҡ„дё»иҰҒжҲҗеҲҶжҳҜ______________гҖӮ(еҶҷеҢ–еӯҰејҸ) пјҲ3пјүиҜ·еҶҷеҮәAеҲ°Cзҡ„ж–№зЁӢејҸ _________________________________________________гҖӮ
|
|
- й«ҳдәҢеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еҙҮе·ҰеёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- 2019е№ҙиҮі2020е№ҙй«ҳдәҢдёҠеӯҰжңҹејҖеӯҰиҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲеұұдёңзңҒж·„еҚҡеёӮж·„е·қдёӯеӯҰпјү
- еұұдёңжөҺеҚ—еӨ–еӣҪиҜӯеӯҰж Ў2020еұҠй«ҳдёү9жңҲжөӢиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдёҖдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲй»‘йҫҷжұҹзңҒеӨ§еәҶеёӮ第еҚҒдёӯеӯҰпјү
- еҚ—йҖҡеёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·еҲ·йўҳи®ӯз»ғ
- 2019е№ҙиҮі2020е№ҙй«ҳдәҢдёҠеӯҰжңҹејҖеӯҰиҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲдә‘еҚ—зңҒзҹіеұҸеҺҝдәҢдёӯпјү
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•иҜ•еҚ·е®Ңж•ҙзүҲ
 В В В В B.
В В В В B. 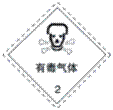 В В В В C.
В В В В C.  В В В В D.
В В В В D.