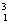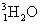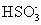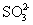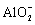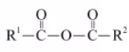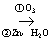2021年高考北京卷化学真题含答案解析
| 1. | 详细信息 |
|
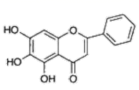
我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法不正确的是 A . 分子中有 3 种官能团 B . 能与 Na 2 CO 3 溶液反应 C . 在空气中可发生氧化反应 D . 能和 Br 2 发生取代反应和加成反应 |
|
| 2. | 详细信息 |
|
下列有关放射性核素氚( A . C . |
|
| 3. | 详细信息 |
|
下列化学用语或图示表达不正确的是 A . N 2 的结构式: N≡N B . Na + 的结构示意图: C . 溴乙烷的分子模型: |
|
| 4. | 详细信息 |
|
下列性质的比较,不能用元素周期律解释的是 A . 酸性: HClO 4 > H 2 SO 3 > H 2 SiO 3 B . 碱性: KOH>NaOH>LiOH C . 热稳定性: H 2 O>H 2 S>PH 3 D . 非金属性: F > O > N |
|
| 5. | 详细信息 | |||||||||||||||||||||||||
|
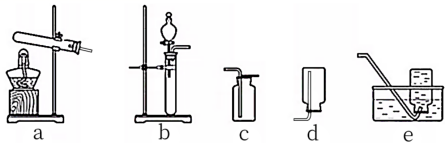
实验室制备下列气体所选试剂、制备装置及收集方法均正确的是
A . A B . B C . C D . D |
||||||||||||||||||||||||||
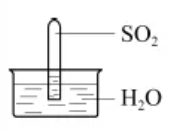
| 6. | 详细信息 |
|
室温下, 1 体积的水能溶解约 40 体积的 SO 2 。用试管收集 SO 2 后进行如下实验。对实验现象的分析正确的是 A . 试管内液面上升,证明 SO 2 与水发生了反应 B . 试管中剩余少量气体,是因为 SO 2 的溶解已达饱和 C . 取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是: SO 2 +H 2 O ⇌ H 2 SO 3 、 H 2 SO 3 ⇌ H + + D . 取出试管中溶液,在空气中放置一段时间后 pH 下降,是由于 SO 2 挥发 |
|
| 7. | 详细信息 |
|
下列方程式不能准确解释相应实验现象的是 A . 酚酞滴入醋酸钠溶液中变为浅红色: CH 3 COO - + H 2 O ⇌ CH 3 COOH + OH - B . 金属钠在空气中加热生成淡黄色固体: 4Na + O 2 = 2Na 2 O C . 铝溶于氢氧化钠溶液,有无色气体产生: 2Al + 2OH - + 2H 2 O = 2 D . 将二氧化硫通入氢硫酸中产生黄色沉淀: SO 2 + 2H 2 S = 3S ↓+ 2H 2 O |
|
| 8. | 详细信息 | |||||||||||||||
|
使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现 “亮→暗(或灭)→亮”现象的是
A . A B . B C . C D . D |
||||||||||||||||
| 9. | 详细信息 |
|
用电石(主要成分为 CaC 2 ,含 CaS 和 Ca 3 P 2 等)制取乙炔时,常用 CuSO 4 溶液除去乙炔中的杂质。反应为 : ①CuSO 4 + H 2 S = CuS ↓+ H 2 SO 4 ②11PH 3 + 24CuSO 4 + 12H 2 O = 3H 3 PO 4 + 24H 2 SO 4 + 8Cu 3 P ↓ 下列分析不正确的是 A . CaS、Ca 3 P 2 发生水解反应的化学方程式: CaS+2H 2 O=Ca(OH) 2 +H 2 S↑、Ca 3 P 2 +6H 2 O=3Ca(OH) 2 +2PH 3 ↑ B . 不能依据反应 ①比较硫酸与氢硫酸的酸性强弱 C . 反应 ②中每 24 mol CuSO 4 氧化 11 mol PH 3 D .用酸性 KMnO 4 溶液验证乙炔还原性时, H 2 S 、 PH 3 有干扰 |
|
| 10. | 详细信息 |
|
NO 2 和 N 2 O 4 存在平衡 : 2NO 2 (g) ⇌ N 2 O 4 (g) △ H<0 。下列分析正确的是 A . 1 mol 平衡混合气体中含 1 mol N 原子 B . 断裂 2 mol NO 2 中的共价键所需能量小于断裂 1 mol N 2 O 4 中的共价键所需能量 C . 恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 D . 恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅 |
|
| 11. | 详细信息 |
|
可生物降解的高分子材料聚苯丙生 ( L )的结构片段如下图。 下列有关 L 的说法不正确的是 A . 制备 L 的单体分子中都有两个羧基 B . 制备 L 的反应是缩聚反应 C . L 中的官能团是酯基和醚键 D . m 、 n 、 p 和 q 的大小对 L 的降解速率有影响 |
|
| 12. | 详细信息 |
|
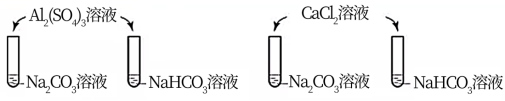
下列实验中,均产生白色沉淀。 A . Na 2 CO 3 与 NaHCO 3 溶液中所含微粒种类相同 B . CaCl 2 能促进 Na 2 CO 3 、 NaHCO 3 水解 C . Al 2 (SO 4 ) 3 能促进 Na 2 CO 3 、 NaHCO 3 水解 D . 4个实验中,溶液滴入后,试管中溶液pH均降低 |
|
| 13. | 详细信息 |
|
有科学研究提出 : 锂电池负极材料 (Li) 由于生成 LH 而不利于电池容量的保持。一定温度下,利用足量重水 (D 2 O )与含 LiH 的 Li 负极材料反应,通过测定 n(D 2 )/n(HD) 可以获知 n(Li)/n(LiH) 。 已知: ①LiH+H 2 O=LiOH+H 2 ↑ ②2Li(s)+H 2 ⇌2LiH △H < 0 下列说法不正确的是 A . 可用质谱区分 D 2 和 HD B . Li 与 D 2 O 的反应: 2Li+2D 2 O=2LiOD+D 2 ↑ C . 若 n(Li)/n(LiH) 越大,则 n(D 2 )/n(HD) 越小 D . 80℃ 反应所得 n(D 2 )/n(HD) 比 25℃ 反应所得 n(D 2 )/n(HD) 大 |
|
| 14. | 详细信息 |
|
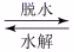
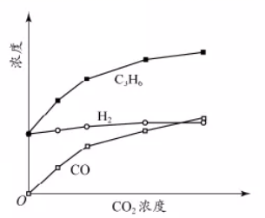
丙烷经催化脱氢可制丙烯 :C 3 H 8 已知: ①C 3 H 8 (g)+5O 2 (g)=3CO 2 (g)+4H 2 O(l) △H=-2220kJ/mol ②C 3 H 6 (g)+9/2O 2 (g)=3CO 2 (g)+3H 2 O(l) △H=-2058kJ/mol ③H 2 (g)+1/2O 2 (g)=H 2 O(l) △H=-286kJ/mol 下列说法不正确的是 A . C 3 H 8 (g)=C 3 H 6 (g)+H 2 (g) △H=+124kJ/mol B . c(H 2 ) 和 c(C 3 H 6 ) 变化差异的原因: CO 2 +H 2 C . 其他条件不变,投料比 c(C 3 H 8 )/c(CO 2 ) 越大, C 3 H 8 转化率越大 D . 若体系只有 C 3 H 6 、 CO 、 H 2 和 H 2 O 生成,则初始物质浓度 c 0 与流出物质浓度 c 之间一定存在: 3c 0 (C 3 H 8 )+c 0 (CO 2 )=c(CO)+c(CO 2 )+3c(C 3 H 8 )+3c(C 3 H 6 ) |
|
| 15. | 详细信息 |
|
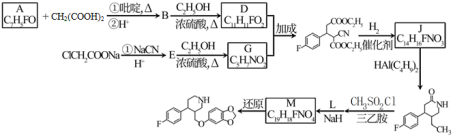
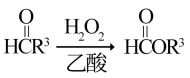
治疗抑郁症的药物帕罗西汀的合成路线如下。 已知: i.R 1 CHO+CH 2 (COOH) 2 ii.R 2 OH ( 1 ) A 分子含有的官能团是 _______ 。 ( 2 ) 已知: B 为反式结构。下列有关 B 的说法正确的是 ( 填序号 ) _______ 。 a .核磁共振氢谱有 5 组峰 b .能使酸性 KMnO 4 溶液褪色 c .存在 2 个六元环的酯类同分异构体 d .存在含苯环和碳碳三键的羧酸类同分异构体 ( 3 ) E→G 的化学方程式是 _______ 。 ( 4 ) J 分子中有 3 个官能团,包括 1 个酯基。 J 的结构简式是 _______ 。 ( 5 ) L 的分子式为 C 7 H 6 O 3 。 L 的结构简式是 _______ 。 ( 6 ) 从黄樟素经过其同分异构体 N 可制备 L 。 已知: i.R 1 CH=CHR 2 ii. 写出制备 L 时中间产物 N 、 P 、 Q 的结构简式: _______ 、 _______ 、 _______ 。 |
|
| 16. | 详细信息 |
|
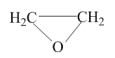
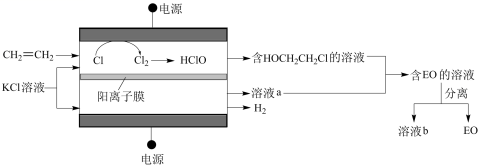
环氧乙烷 ( ( 1 ) ①阳极室产生 Cl 2 后发生的反应有: _______ 、 CH 2 =CH 2 +HClO→HOCH 2 CH 2 Cl 。 ②结合电极反应式说明生成溶液 a 的原理 _______ 。 ( 2 ) 一定条件下,反应物按一定流速通过该装置。 η(B)= S(B)= ①若 η(EO)=100% ,则溶液 b 的溶质为 _______ 。 ②当乙烯完全消耗时,测得 η(EO)≈70% , S(EO)≈97% ,推测 η(EO)≈70% 的原因: I. 阳极有 H 2 O 放电 II. 阳极有乙烯放电 III. 阳极室流出液中含有 Cl 2 和 HClO …… i. 检验电解产物,推测 I 不成立。需要检验的物质是 _______ 。 ii. 假设没有生成 EO 的乙烯全部在阳极放电生成 CO 2 , η(CO 2 )≈ _______ % 。经检验阳极放电产物没有 CO 2 。 iii. 实验证实推测 III 成立,所用试剂及现象是 _______ 。 可选试剂: AgNO 3 溶液、 KI 溶液、淀粉溶液、品红溶液。 |
|
| 17. | 详细信息 |
|
某小组实验验证 “Ag + +Fe 2+ ( 1 ) 实验验证 实验 I :将 0.0100 mol/L Ag 2 SO 4 溶液与 0.0400 mo/L FeSO 4 溶液 (pH=1) 等体积混合,产生灰黑色沉淀,溶液呈黄色。 实验 II :向少量 Ag 粉中加入 0.0100 mol/L Fe 2 (SO 4 ) 3 溶液 (pH=1) ,固体完全溶解。 ①取 I 中沉淀,加入浓硝酸,证实沉淀为 Ag 。现象是 _______ 。 ② II 中溶液选用 Fe 2 (SO 4 ) 3 ,不选用 Fe(NO 3 ) 3 的原因是 _______ 。 综合上述实验,证实 “Ag + +Fe 2+ ③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图 , 写出操作及现象 _______ 。 ( 2 ) 测定平衡常数 实验 Ⅲ :一定温度下,待实验 Ⅰ 中反应达到平衡状态时,取 v mL 上层清液,用 c 1 mol/L KSCN 标准溶液滴定 Ag + ,至出现稳定的浅红色时消耗 KSCN 标准溶液 v 1 mL 。 资料: Ag + +SCN - Fe 3+ +SCN - ①滴定过程中 Fe 3+ 的作用是 _______ 。 ②测得平衡常数 K = _______ 。 ( 3 ) 思考问题 ①取实验 I 的浊液测定 c (Ag + ) ,会使所测 K 值 _______ ( 填 “ 偏高 ”“ 偏低 ” 或 “ 不受影响 ”) 。 ②不用实验 II 中清液测定 K 的原因是 _______ 。 |
|
| 18. | 详细信息 |
|
铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。 资料: i. 钛白粉废渣成分:主要为 FeSO 4 ·H 2 O ,含少量 TiOSO 4 和不溶物 ii.TiOSO 4 +( x+1 )H 2 O ⇌ TiO 2 ·xH 2 O↓+H 2 SO 4 iii.0.1 mol/L Fe 2+ 生成 Fe(OH) 2 ,开始沉淀时 pH = 6.3 ,完全沉淀时 pH = 8.3 ; 0.1 mol/L Fe 3+ 生成 FeOOH ,开始沉淀时 pH = 1.5 ,完全沉淀时 pH = 2.8 ( 1 ) 纯化 ①加入过量铁粉的目的是 _______ 。 ②充分反应后,分离混合物的方法是 _______ 。 ( 2 ) 制备晶种 为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 FeSO 4 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 pH 为 6.0 时开始通空气并记录 pH 变化 ( 如图 ) 。 ①产生白色沉淀的离子方程式是 _______ 。 ②产生白色沉淀后的 pH 低于资料 iii 中的 6.3 。原因是:沉淀生成后 c(Fe 2+ ) _______ 0.1mol/L( 填 “ > ”“ = ” 或 “ < ”) 。 ③ 0-t 1 时段, pH 几乎不变; t 1 -t 2 时段, pH 明显降低。结合方程式解释原因: _______ 。 ④ pH ≈ 4 时制得铁黄晶种。若继续通入空气, t 3 后 pH 几乎不变,此时溶液中 c(Fe 2+ ) 仍降低,但 c(Fe 3+ ) 增加,且 (Fe 2+ ) 降低量大于 c(Fe 3+ ) 增加量。结合总方程式说明原因: _______ 。 ( 3 ) 产品纯度测定 铁黄纯度可以通过产品的耗酸量确定。 wg 铁黄 资料: Fe 3+ +3 Na 2 C 2 O 4 过量,会使测定结果 _______ ( 填 “ 偏大 ”“ 偏小 ” 或 “ 不受影响 ”)。 |
|
| 19. | 详细信息 | ||||||||||||||
|
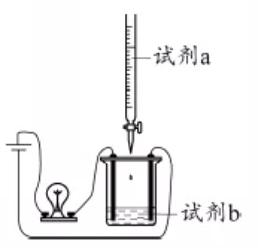
某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。 ( 1 ) 浓盐酸与 MnO 2 混合加热生成氯气。氯气不再逸出时,固液混合物 A 中仍存在盐酸和 MnO 2 。 ①反应的离子方程式是 _______ 。 ②电极反应式: i. 还原反应: MnO 2 +2e - +4H + =Mn 2+ +2H 2 O ii. 氧化反应: _______ 。 ③根据电极反应式,分析 A 中仍存在盐酸和 MnO 2 的原因。 i. 随 c(H + ) 降低或 c(Mn 2+ ) 浓度升高, MnO 2 氧化性减弱。 ii. 随 c(Cl - ) 降低, _______ 。 ④补充实验证实了③中的分析。
a是 _______ , b 是 _______ 。 ( 2 ) 利用 c(H + ) 浓度对 MnO 2 氧化性的影响,探究卤素离子的还原性。相同浓度的 KCl 、 KBr 和 KI 溶液,能与 MnO 2 反应所需的最低 c(H + ) 由大到小的顺序是 _______ ,从原子结构角度说明理由 ______________ 。 ( 3 ) 根据 (1) 中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将 Mn 2+ 氧化为 MnO 2 。经实验证实了推测,该化合物是 _______ 。 ( 4 ) Ag 分别与 1mol·L 1 的盐酸、氢溴酸和氢碘酸混合, Ag 只与氢碘酸发生置换反应,试解释原因: _______ 。 ( 5 ) 总结:物质氧化性和还原性变化的一般规律是 _______ 。 |
|||||||||||||||