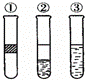2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
鉴别Cl-、Br-、I-可以选用的试剂是 ( ) A.碘水、淀粉溶液 B.氯水、四氯化碳 C.溴水、汽油 D.硝酸银溶液、稀硝酸
|
|
| 2. | 详细信息 |
|
下列说法正确的是: ①液氨不导电,能够证明NH3是共价化合物的是 ②NaHCO3晶体中的阳离子和阴离子个数比为2:1 ③BaO2(过氧化钡)固体中的阴离子和阳离子个数比为2:1 ④CO2分子中,所有原子都满足最外层为8电子结构 A.①② B. ②④ C. ①④ D. ③④
|
|
| 3. | 详细信息 |
|
化学与人体健康密切相关。市场上有“高钙牛奶”、“加氟牙膏”、“葡萄糖酸锌”等商品,这里的“钙、氟、锌”应理解为 A.分子 B.元素 C.同位素 D.单质
|
|
| 4. | 详细信息 |
|
用26.4 g(NH4)2SO4跟过量的Ca(OH)2混合加热,放出的气体全部被含有39.2 g的H3PO4溶液吸收,生成的盐是( ) A.(NH4)3PO4 B.NH4H2PO4 C.(NH4)2HPO4 D.(NH4)3PO4和NH4H2PO4
|
|
| 5. | 详细信息 |
|
下列仪器: ①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥量筒 ⑦燃烧匙,常用于物质分离的是 A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
|
|
| 6. | 详细信息 |
|
化学与科学、技术、社会、环境密切相关。下列叙述正确的是 A.普通玻璃的主要成分是纯碱、石灰石和二氧化硅 B.“光化学烟雾”与碳氢化合物和氮氧化合物的大量排放有关 C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 D.C、S分别在空气中燃烧均可得到两种不同的氧化物
|
|
| 7. | 详细信息 |
|
某合作学习小组讨论辨析: ①漂白粉和酸雨都是混合物; ②煤和石油都是可再生能源; ③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质; ④不锈钢和目前流通的硬币都是合金: ⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;⑥豆浆和雾都是胶体。 上述说法正确的是 A.①②④⑤ B.①②⑤⑥ C.①③④⑥ D.②③④⑤
|
|
| 8. | 详细信息 |
|
下列离子方程式正确的是
|
|
| 9. | 详细信息 |
|
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中产物中一定不存在同分异构体的是( ) A.邻羟基苯甲酸与NaHCO3溶液反应 B.2-氯丁烷( C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应 D.异戊二烯(
|
|
| 10. | 详细信息 |
|
银锌电池广泛用作电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O=2Ag+Zn(OH) 2 ,则负极上发生反应的物质是 A.Ag B.Zn(OH)2 C.Ag2O D.Zn
|
|
| 11. | 详细信息 |
|
下列每组中各物质内既有离子键又有共价键的一组是 A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3 C.Na2O2、KOH、Na2SO4 D.HCl、Al2O3、MgCl2
|
|
| 12. | 详细信息 |
|
下列实验操作中正确的是 A.蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处 B.制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 C.分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 D.测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较
|
|
| 13. | 详细信息 |
|
下列关于醋酸钠溶液的说法中正确的是 A.溶液呈酸性 B.c(H+)= c(CH3COO-)+ c(OH-) C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
|
|
| 14. | 详细信息 |
|
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( )
A.①是苯,②是CCl4,③是酒精 B.①是酒精,②是CCl4,③是苯 C.①是CCl4,②是苯,③是酒精 D.①是苯,②是酒精,③是CCl4
|
|
| 15. | 详细信息 |
|
下列叙述中错误的是(用NA代表阿伏加德罗常数的值) ( ) ①46gNO2和N2O4的混合气体中含N原子总数为NA ;②用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA ;③7.8g Na2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023 ;④标准状况下,22.4L H2O含有的分子数为NA ;⑤等物质的量的NH4+和OH-含电子数均为10NA A.①②③④⑤ B. ①③④⑤ C. ②③④⑤ D. ③④⑤
|
|
| 16. | 详细信息 |
|
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式) (2)周期表中位于第8纵行的铁元素属于第 族。 (3)周期表中最活泼的非金属元素位于第 纵行 族。
|
|
| 17. | 详细信息 | ||||||||||||||||||||
|
1 L某混合溶液,可能含有的离子如下表:
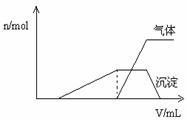
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(
则该溶液中确定含有的离子有 ; 不能确定是否含有的阳离子有 , 要确定其存在可补充做的实验是 ; 肯定不存在的阴离子有 。 (2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
|
|||||||||||||||||||||
| 18. | 详细信息 |
|
硝酸在化学工业中有着极其广泛的应用。 (1)将1.25 mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。 (2)向稀硝酸中加入18.4 mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8 g/cm3)以下时,则失去吸水能力。50 mL 18.4 mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。 (3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比 (4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x = 。
|
|
| 19. | 详细信息 |
|
1)某酯的分子式为C6H12O2,其变化如图所示:
若A能发生银镜反应,C不能发生银镜反应,则该酯的可能结构有 种。 (2)将
则a试剂是 ,b试剂是 。
|
|
| 20. | 详细信息 | ||||||||||||
|
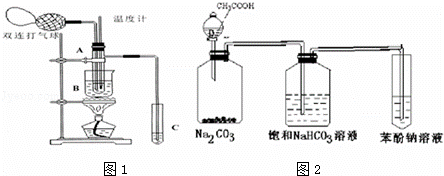
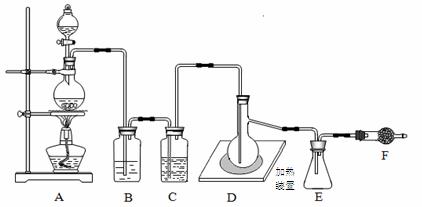
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图1所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) . (2)烧杯B的作用是:①使试管A内的反应液均匀受热发生反应,② ;烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找). (3)若想检验试管C中是否含有产物乙酸,在下列提供的试剂和试纸中可以选用 .(填序号).实验仪器任选.所提供的试剂和试纸有: a.pH试纸 b.红色的石蕊试纸 c.白色的醋酸铅试纸 d.碳酸氢钠粉末. (4)实验室可以用下列装置如图2来探究乙酸、苯酚、碳酸的酸性强弱. ①饱和碳酸氢钠溶液的作用是 . ②苯酚钠溶液中应观察到 ,有关的化学方程式 .
|
|||||||||||||
| 21. | 详细信息 | |||||||||||||||
|
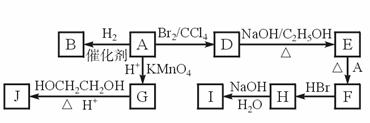
已知:
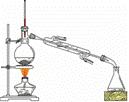
根据题意完成下列填空: (一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:________________________________ (2)反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。 a.天平 b.量筒 c.容量瓶 d.滴定管 (3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。 (4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。 a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤 (二)制备精品 将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。
(5)收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。 (6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
|
||||||||||||||||
| 22. | 详细信息 |
|
氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下: S(s)+Cl2(g) SCl2(l)+SO3(l)===SOCl2(l)+ SO2(g) (Ⅱ) 已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。
(1)仪器组装完成后,首先进行的一步操作是 ;反应前要先排尽系统中空气,此做法目的是 。 (2)装置B盛放的药品是 ,装置D中玻璃仪器的名称是 ,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 。 (3)实验时,为防止E中液体挥发,可采取的措施是______。装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是 。 (4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为______;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论______。 已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O 供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液
|
|
| 23. | 详细信息 |
|
下图中A-J均为有机化合物,根据图中的信息,回答下列问题:
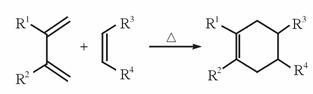
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为______; (2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______; (3)由A生成D的反应类型是______,由D生成E的反应类型是______; (4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为______; (5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
则由E和A反应生成F的化学方程式为______; (6)H中含有的官能团是______,I中含有的官能团是______。
|
|
| 24. | 详细信息 |
|
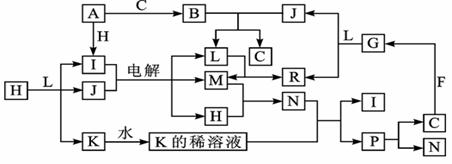
已知下列各物质都是由短周期元素组成,它们之间的关系如下图所示:
常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色。请回答: (1)P的结构式为 ,B的电子式为 。 (2)R的水溶液呈碱性的原因可用离子方程式表示为 。 (3)还有一种物质能与B反应生成C,写出这个反应的化学方程式 。 (4)还有一种单质能与J反应生成C,写出这个反应的化学方程式 。 (5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式______________。
|
|