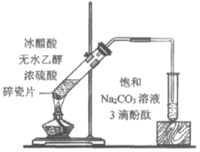
2020еҢ—дә¬й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
дёӯеӣҪдј з»ҹж–ҮеҢ–дёӯеҢ…жӢ¬и®ёеӨҡ科жҠҖзҹҘиҜҶгҖӮдёӢеҲ—еҸӨиҜӯдёӯдёҚж¶үеҸҠеҢ–еӯҰеҸҳеҢ–зҡ„жҳҜ
A. AВ В В В В В В В В В В В В В В В В В B. BВ В В В В В В В В В В В В В В В В В C. CВ В В В В В В В В В В В В В В В В В D. D
|
|||||||||
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„з”ЁйҖ”еҲ©з”ЁдәҶе…¶иҝҳеҺҹжҖ§зҡ„жҳҜ A. з”Ёи‘Ўиҗ„зі–еҲ¶й•ңжҲ–дҝқ温瓶иғҶВ В В В В В В В В В В В В В В В В В В В B. з”Ё C. з”Ё
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. 7.8gNa2O2дёӯйҳҙзҰ»еӯҗж•°дёә0.1NA B. 1molз”Іеҹәеҗ«жңүзҡ„з”өеӯҗж•°дёә7NA C. еёёжё©еёёеҺӢдёӢпјҢ2.24 Lд№ҷзғҜдёӯеҗ«жңүзҡ„ж°ўеҺҹеӯҗж•°дёә0.4NA D. 0.1L 0.5molВ·LпјҚ1CH3COOHжә¶ж¶Ідёӯеҗ«жңүзҡ„ж°ўзҰ»еӯҗж•°дёә0.05NA
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
иҫЈжӨ’зҙ жҳҜеҪұе“ҚиҫЈжӨ’иҫЈе‘ізҡ„жҙ»жҖ§жҲҗеҲҶзҡ„з»ҹз§°пјҢе…¶дёӯдёҖз§ҚеҲҶеӯҗзҡ„з»“жһ„еҰӮдёӢеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іиҜҘеҲҶеӯҗзҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
A. еҲҶеӯҗејҸдёәC18H27NO3 B. еҗ«жңүж°§еҺҹеӯҗзҡ„е®ҳиғҪеӣўжңү3з§Қ C. иғҪеҸ‘з”ҹеҠ иҒҡеҸҚеә”гҖҒж°ҙи§ЈеҸҚеә” D. иҜҘеҲҶеӯҗдёҚеӯҳеңЁйЎәеҸҚејӮжһ„
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүжңәзү©AB2гҖҒ AB4гҖҒ AB8еқҮеҸҜеҪўжҲҗжһқзҠ¶й«ҳеҲҶеӯҗABmгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
A. AB2еҲҶеӯҗдёӯжңү4з§ҚдёҚеҗҢеҢ–еӯҰзҺҜеўғзҡ„ж°ўеҺҹеӯҗ B. AB4ж—ўиғҪдёҺејәй…ёеҸҚеә”д№ҹиғҪдёҺејәзўұеҸҚеә” C. AB2з”ҹжҲҗABmжҳҜзј©иҒҡеҸҚеә” D. ABmзҡ„з»“жһ„з®ҖејҸжҳҜ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—и§ЈйҮҠдәӢе®һзҡ„ж–№зЁӢејҸдёҚжӯЈзЎ®зҡ„жҳҜ A. з”Ёй“қеҶ¶зӮјй“Ғпјҡ2AlпјӢFe2O3 B. еёёжё©ж—¶пјҢ0.1molВ·LпјҚ1ж°Ёж°ҙзҡ„pHпјқ11.1пјҡNH3В·H2O C. вҖңNO2зҗғвҖқжөёжіЎеңЁзғӯж°ҙдёӯпјҢйўңиүІеҸҳж·ұпјҡ2NO2пјҲgпјүпјҲзәўжЈ•иүІпјү D. з”Ёй…ёеҢ–зҡ„H2O2жә¶ж¶Ід»ҺзҒ°еҢ–зҡ„жө·еёҰдёӯжҸҗзўҳпјҡH2O2пјӢ2HпјӢпјӢ2I-пјқI2пјӢ2H2O
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗз§‘з ”еӣўйҳҹз ”еҲ¶еҮәвҖңTMп№ЈLiHпјҲTMиЎЁзӨәиҝҮжёЎйҮ‘еұһпјүвҖқеҸҢеӮ¬еҢ–еүӮдҪ“зі»пјҢжҳҫи‘—жҸҗй«ҳдәҶеңЁжё©е’ҢжқЎд»¶дёӢж°®ж°”е’Ңж°ўж°”еҗҲжҲҗNH3зҡ„ж•ҲзҺҮпјҢеҺҹзҗҶзӨәж„ҸеҰӮдёӢпјҡ
дёӢеҲ—еҲҶжһҗдёҚеҗҲзҗҶзҡ„жҳҜпјҲгҖҖгҖҖпјү A. зҠ¶жҖҒв… пјҢеҗёж”¶иғҪйҮҸ并жңүNвүЎNй”®еҸ‘з”ҹж–ӯиЈӮВ В В В В В В В B. еҗҲжҲҗNH3жҖ»еҸҚеә”зҡ„еҺҹеӯҗеҲ©з”ЁзҺҮжҳҜ100% C. вҖңTMп№ЈLiHвҖқиғҪйҷҚдҪҺеҗҲжҲҗж°ЁеҸҚеә”зҡ„в–іHВ В В В В В В В В В D. з”ҹжҲҗNH3пјҡ2LiNH+3H2в•җ2LiH+2NH3
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёәзӣ‘жөӢз©әж°”дёӯжұһи’ёж°”жҳҜеҗҰи¶…ж ҮпјҢйҖҡиҝҮжӮ¬жҢӮж¶ӮжңүCuIпјҲзҷҪиүІпјүзҡ„ж»ӨзәёпјҢж №жҚ®ж»ӨзәёжҳҜеҗҰеҸҳиүІпјҲдә®й»„иүІиҮіжҡ—зәўиүІпјүеҸҠеҸҳиүІжүҖйңҖж—¶й—ҙжқҘеҲӨж–ӯз©әж°”дёӯзҡ„жұһеҗ«йҮҸгҖӮеҸ‘з”ҹзҡ„еҢ–еӯҰеҸҚеә”дёәпјҡ4CuIпјӢHgпјқCu2HgI4пјӢ2CuгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. дёҠиҝ°еҸҚеә”еұһдәҺзҪ®жҚўеҸҚеә” B. Cu2HgI4ж—ўжҳҜж°§еҢ–дә§зү©еҸҲжҳҜиҝҳеҺҹдә§зү© C. иҜҘеҸҚеә”дёӯзҡ„ж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2пјҡ1 D. еҪ“жңү1mol CuIеҸӮдёҺеҸҚеә”ж—¶пјҢиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёә0.5mol
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘AgClжөҠж¶Ідёӯж»ҙеҠ ж°Ёж°ҙеҗҺеҸҜеҫ—еҲ°жҫ„жё…жә¶ж¶ІпјҢ继з»ӯж»ҙеҠ жө“зЎқй…ёеҗҺеҸҲжңүжІүж·Җз”ҹжҲҗгҖӮз»ҸжҹҘиө„ж–ҷеҫ—зҹҘпјҡAg++ 2NH3В·H2O A. жөҠж¶ІдёӯеӯҳеңЁжІүж·Җжә¶и§Је№іиЎЎпјҡAgCl (s) B. е®һйӘҢеҸҜд»ҘиҜҒжҳҺNH3з»“еҗҲAg+иғҪеҠӣжҜ”ClпјҚејә C. е®һйӘҢиЎЁжҳҺе®һйӘҢе®ӨеҸҜз”Ёж°Ёж°ҙжҙ—ж¶Ө银й•ңеҸҚеә”еҗҺзҡ„иҜ•з®Ў D. з”ұиө„ж–ҷдҝЎжҒҜеҸҜжҺЁзҹҘпјҡеҠ жө“зЎқй…ёеҗҺз”ҹжҲҗзҡ„жІүж·ҖдёәAgCl
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
.еҗ‘зўій…ёжә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІпјҢжөӢеҫ—зўій…ёдёӯеҗ«зўіеҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°йҡҸpHеҸҳеҢ–еҰӮдёӢеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
A. дәәдҪ“иЎҖж¶Ізҡ„pHпјқ7.35пҪһ7.45пјҢе…¶дёӯеҗ«зўіеҫ®зІ’д»ҘHCO3пјҚгҖҒH2CO3дёәдё» B. йҷӨеҺ»NaClжә¶ж¶ІдёӯNa2CO3зҡ„ж–№жі•жҳҜеҗ‘е…¶дёӯеҠ е…Ҙзӣҗй…ёиҮіpHпјқ7 C. pHпјқ10зҡ„жә¶ж¶ІдёӯcпјҲHпјӢпјүпјӢcпјҲNaпјӢпјүпјқcпјҲHCO3пјҚпјүпјӢ2cпјҲCO32пјҚпјүпјӢcпјҲOHпјҚпјү D. е°ҶCO2йҖҡе…ҘNaOHжә¶ж¶ІеҲ¶еҸ–Na2CO3пјҢеә”еӨ§зәҰжҺ§еҲ¶pH>12.5
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҒзғҜпјҲC4H8пјүжҳҜеҲ¶еӨҮзәҝжҖ§дҪҺеҜҶеәҰиҒҡд№ҷзғҜпјҲLLDPEпјүзҡ„еҺҹж–ҷд№ӢдёҖпјҢеҸҜз”ұдёҒзғ·пјҲC4H10пјүеӮ¬еҢ–и„ұж°ўеҲ¶еӨҮпјҢC4H10пјҲgпјү
дёӢеҲ—еҲҶжһҗжӯЈзЎ®зҡ„жҳҜ A. йҡҸжё©еәҰеҚҮй«ҳдёҒзғҜиЈӮи§Јз”ҹжҲҗзҡ„еүҜдә§зү©еўһеӨҡпјҢдјҡеҪұе“ҚдёҒзғҜзҡ„дә§зҺҮ B. дёҒзғ·еӮ¬еҢ–и„ұж°ўжҳҜеҗёзғӯеҸҚеә”пјҢдёҒзғҜзҡ„дә§зҺҮйҡҸжё©еәҰеҚҮй«ҳиҖҢдёҚж–ӯеўһеӨ§ C. ж°ўж°”зҡ„дҪңз”ЁжҳҜжҙ»еҢ–еӣәдҪ“еӮ¬еҢ–еүӮпјҢж”№еҸҳж°ўж°”йҮҸдёҚдјҡеҪұе“ҚдёҒзғҜзҡ„дә§зҺҮ D. дёҖе®ҡжё©еәҰдёӢпјҢжҺ§еҲ¶иҝӣж–ҷжҜ”[
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
жё©еәҰдёәT1ж—¶пјҢе°Ҷж°”дҪ“Xе’Ңж°”дҪ“Yеҗ„1.6molе……е…Ҙ10LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”XпјҲgпјү+YпјҲgпјү
A. еҸҚеә”0пҪһ4min B. T1ж—¶пјҢеҸҚеә”зҡ„е№іиЎЎеёёж•°K1=1.2 C. е…¶д»–жқЎд»¶дёҚеҸҳпјҢ9minеҗҺпјҢеҗ‘е®№еҷЁдёӯеҶҚе……е…Ҙ1.6molXпјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁпјҢеҶҚж¬ЎиҫҫеҲ°е№іиЎЎж—¶Xзҡ„жө“еәҰеҮҸе°ҸпјҢYзҡ„иҪ¬еҢ–зҺҮеўһеӨ§ D. е…¶д»–жқЎд»¶дёҚеҸҳпјҢиӢҘйҷҚжё©еҲ°T2иҫҫеҲ°е№іиЎЎж—¶пјҢе№іиЎЎеёёж•°K2=4пјҢеҲҷжӯӨеҸҚеә”зҡ„в–іHпјң0
|
|||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
дёӢеҲ—е®һйӘҢжүҖеҫ—з»“и®әжӯЈзЎ®зҡ„жҳҜ
A. в‘ дёӯжә¶ж¶ІзәўиүІиӨӘеҺ»зҡ„еҺҹеӣ жҳҜпјҡCH3COOC2H5пјӢNaOH B. в‘Ўдёӯжә¶ж¶ІеҸҳзәўзҡ„еҺҹеӣ жҳҜпјҡCH3COOпјҚпјӢH2O C. з”ұе®һйӘҢв‘ гҖҒв‘ЎгҖҒв‘ўжҺЁжөӢпјҢв‘ дёӯзәўиүІиӨӘеҺ»зҡ„еҺҹеӣ жҳҜд№ҷй…ёд№ҷй…ҜиҗғеҸ–дәҶй…ҡй…һ D. в‘ЈдёӯзәўиүІиӨӘеҺ»иҜҒжҳҺеҸідҫ§е°ҸиҜ•з®Ўдёӯ收йӣҶеҲ°зҡ„д№ҷй…ёд№ҷй…Ҝдёӯж··жңүд№ҷй…ё
|
|||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. ж·ҖзІүгҖҒзәӨз»ҙзҙ еҸҠе…¶ж°ҙи§Јдә§зү©йғҪеұһдәҺзі–зұ» B. еҲ¶дҪңйӣҶжҲҗз”өи·Ҝжқҝзҡ„й…ҡйҶӣж ‘и„ӮеұһдәҺеҗҲжҲҗй«ҳеҲҶеӯҗ C. з”ҳжІ№е’Ңж°Ёеҹәй…ёеңЁдёҖе®ҡжқЎд»¶дёӢйғҪиғҪеҸ‘з”ҹй…ҜеҢ–еҸҚеә” D. иӣӢзҷҪиҙЁжә¶ж¶ІдёӯеҠ йҶӢй…ёй“…жә¶ж¶Ідә§з”ҹзҡ„жІүж·ҖиғҪйҮҚж–°жә¶дәҺж°ҙ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
иҗңзұ»еҢ–еҗҲзү©е№ҝжіӣеҲҶеёғдәҺжӨҚзү©гҖҒжҳҶиҷ«еҸҠеҫ®з”ҹзү©дҪ“еҶ…пјҢжҳҜеӨҡз§ҚйҰҷж–ҷе’ҢиҚҜзү©зҡ„дё»иҰҒжҲҗеҲҶгҖӮв… жҳҜдёҖз§Қиҗңзұ»еҢ–еҗҲзү©пјҢе®ғзҡ„еҗҲжҲҗи·ҜзәҝеҰӮдёӢпјҡ
е·ІзҹҘпјҡRгҖҒRвҖҷгҖҒRвҖқ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүжҢүе®ҳиғҪеӣўеҲҶзұ»пјҢAзҡ„зұ»еҲ«жҳҜ______________гҖӮ пјҲ2пјүAвҶ’Cзҡ„еҸҚеә”зұ»еһӢжҳҜ______________гҖӮ пјҲ3пјүCвҶ’DгҖҒEвҶ’Fзҡ„еҢ–еӯҰж–№зЁӢејҸеҲҶеҲ«жҳҜ______________гҖҒ______________гҖӮ пјҲ4пјүеҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„з»“жһ„з®ҖејҸпјҡB______________гҖҒH______________гҖӮ пјҲ5пјүFвҶ’Gзҡ„еҸҚеә”дёӯпјҢд№ҷй…ёй…җзҡ„дҪңз”Ё______________гҖӮ пјҲ6пјүеҚҒд№қдё–зәӘжң«O.WallachеҸ‘зҺ°е№¶жҸҗеҮәдәҶвҖңејӮжҲҠдәҢзғҜжі•еҲҷвҖқпјҢеҚіиҮӘ然з•ҢдёӯеӯҳеңЁзҡ„иҗңзұ»еҢ–еҗҲзү©еқҮеҸҜд»ҘзңӢдҪңжҳҜејӮжҲҠдәҢзғҜзҡ„иҒҡеҗҲдҪ“жҲ–иЎҚз”ҹзү©пјҢдёәиЎЁеҪ°д»–еҜ№иҗңзұ»еҢ–еҗҲзү©зҡ„ејҖеҲӣжҖ§з ”究пјҢ1910е№ҙиў«жҺҲдәҲиҜәиҙқе°”еҢ–еӯҰеҘ–гҖӮиҜ·д»ҘCH3CH2OHгҖҒCH3MgIдёәжңүжңәеҺҹж–ҷпјҢз»“еҗҲйўҳзӣ®жүҖз»ҷдҝЎжҒҜпјҢйҖүз”Ёеҝ…иҰҒзҡ„ж— жңәиҜ•еүӮпјҢиЎҘе…ЁејӮжҲҠдәҢзғҜпјҲ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еёӮе”®йЈҹзӣҗеёёжңүж— зўҳзӣҗе’ҢеҠ зўҳзӣҗ(еҗ«KIO3е’Ңе°‘йҮҸзҡ„KI)гҖӮ I. жҹҗеҗҢеӯҰи®ҫи®ЎжЈҖйӘҢйЈҹзӣҗжҳҜеҗҰдёәеҠ зўҳзӣҗзҡ„е®ҡжҖ§е®һйӘҢж–№жі•пјҡ в‘ еҸ–еҫ…жЈҖйЈҹзӣҗжә¶дәҺж°ҙпјҢеҠ е…ҘзЁҖзЎ«й…ёй…ёеҢ–пјҢеҶҚеҠ е…ҘиҝҮйҮҸзҡ„KIжә¶ж¶ІпјҢжҢҜиҚЎгҖӮ в‘ЎдёәйӘҢиҜҒв‘ дёӯжңүI2з”ҹжҲҗпјҢеҗ‘дёҠиҝ°ж··еҗҲж¶ІдёӯеҠ е…Ҙе°‘йҮҸCCl4е……еҲҶжҢҜиҚЎеҗҺпјҢйқҷзҪ®гҖӮ (1)иӢҘдёәеҠ зўҳзӣҗпјҢеҲҷв‘ дёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________гҖӮ (2)в‘Ўдёӯзҡ„е®һйӘҢж“ҚдҪңеҗҚз§°жҳҜ_________гҖӮ (3)е®һйӘҢиҝҮзЁӢдёӯиғҪиҜҒжҳҺйЈҹзӣҗеҗ«KIO3зҡ„зҺ°иұЎжҳҜ_________гҖӮ в…Ў. зўҳж‘„е…ҘиҝҮеӨҡжҲ–иҖ…иҝҮе°‘йғҪдјҡеўһеҠ жӮЈз”ІзҠ¶и…әз–ҫз—…зҡ„йЈҺйҷ©гҖӮзӣ®еүҚеӣҪ家ж ҮеҮҶ(GBпјҸT13025.7)жүҖз”Ёзҡ„йЈҹзӣҗдёӯзўҳеҗ«йҮҸжөӢе®ҡж–№жі•пјҡ в‘ з”ЁйҘұе’Ңжәҙж°ҙе°Ҷзўҳзӣҗдёӯе°‘йҮҸзҡ„IпјҚж°§еҢ–жҲҗIO3пјҚгҖӮ в‘ЎеҶҚеҠ е…Ҙз”Ій…ёеҸ‘з”ҹеҸҚеә”пјҡBr2+HCOOHпјқCO2вҶ‘+2HBrгҖӮ в‘ўеңЁй…ёжҖ§жқЎд»¶дёӢпјҢеҠ е…ҘиҝҮйҮҸKIпјҢдҪҝд№ӢдёҺIO3пјҚе®Ңе…ЁеҸҚеә”гҖӮ в‘Јд»Ҙж·ҖзІүдҪңжҢҮзӨәеүӮпјҢз”ЁNa2S2O3ж ҮеҮҶжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡпјҢжөӢе®ҡзўҳе…ғзҙ зҡ„еҗ«йҮҸгҖӮ I2+2Na2S2O3пјқ2NaI+Na2S4O6 (1)в‘ дёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________гҖӮ (2)жөӢе®ҡйЈҹзӣҗзўҳеҗ«йҮҸиҝҮзЁӢдёӯпјҢNa2S2O3пјҢдёҺIO3пјҚзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә_________гҖӮ (3)жңүдәәжҸҗеҮәдёәз®ҖеҢ–ж“ҚдҪңе°Ҷв‘ гҖҒв‘ЎзңҒз•ҘпјҢдҪҶиҝҷж ·дјҡйҖ жҲҗжөӢе®ҡз»“жһңеҒҸдҪҺгҖӮиҜ·еҲҶжһҗеҒҸдҪҺ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
зӣҙжҺҘжҺ’ж”ҫеҗ«SO2зҡ„зғҹж°”дјҡеҚұе®ізҺҜеўғгҖӮеҲ©з”Ёе·ҘдёҡеәҹзўұжёЈпјҲдё»иҰҒжҲҗеҲҶNa2CO3пјүеҸҜеҗёж”¶зғҹж°”дёӯзҡ„SO2并еҲ¶еӨҮж— ж°ҙNa2SO3пјҢе…¶жөҒзЁӢеҰӮеӣҫ1гҖӮ
е·ІзҹҘпјҡH2SO3гҖҒHSO3пјҚгҖҒSO32пјҚеңЁж°ҙжә¶ж¶Ідёӯзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°йҡҸpHзҡ„еҲҶеёғеҰӮеӣҫ2пјҢ Na2SO3В·7H2Oе’ҢNa2SO3зҡ„жә¶и§ЈеәҰжӣІзәҝеҰӮеӣҫ3гҖӮ
пјҲ1пјүNa2CO3жә¶ж¶ІжҳҫзўұжҖ§пјҢз”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠе…¶еҺҹеӣ пјҡ______________гҖӮ пјҲ2пјүеҗёж”¶зғҹж°” в‘ дёәжҸҗй«ҳNaHSO3зҡ„дә§зҺҮпјҢеә”жҺ§еҲ¶еҗёж”¶еЎ”дёӯзҡ„pHдёә______________гҖӮ в‘ЎNaHSO3жә¶ж¶ІдёӯcпјҲSO32пјҚпјүпјһcпјҲH2SO3пјүпјҢз»“еҗҲж–№зЁӢејҸи§ЈйҮҠе…¶еҺҹеӣ пјҡ____________гҖӮ в‘ўе·ІзҹҘдёӢеҲ—еҸҚеә”пјҡ SO2пјҲgпјүпјӢ2OHпјҚпјҲaqпјүпјқSO32пјҚпјҲaqпјүпјӢH2OпјҲlпјүВ CO2пјҲgпјүпјӢ2OHпјҚпјҲaqпјүпјқCO32пјҚпјҲaqпјүпјӢH2OпјҲlпјүВ 2HSO3пјҚпјҲaqпјүпјқSO32пјҚпјҲaqпјүпјӢSO2пјҲgпјүпјӢH2OпјҲlпјүВ еҗёж”¶еЎ”дёӯNa2CO3жә¶ж¶Іеҗёж”¶SO2з”ҹжҲҗHSO3пјҚзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜ______________гҖӮ в‘Јеҗёж”¶еЎ”дёӯзҡ„жё©еәҰдёҚе®ЈиҝҮй«ҳпјҢеҸҜиғҪзҡ„еҺҹеӣ жҳҜ______________пјҲеҶҷеҮә1з§ҚеҚіеҸҜпјүгҖӮ пјҲ3пјүеҲ¶еӨҮж— ж°ҙNa2SO3:е°Ҷдёӯе’ҢеЎ”дёӯеҫ—еҲ°зҡ„Na2SO3жә¶ж¶І______________пјҲеЎ«ж“ҚдҪңпјүпјҢиҝҮж»ӨеҮәзҡ„еӣәдҪ“з”Ёж— ж°ҙд№ҷйҶҮжҙ—ж¶ӨгҖҒе№ІзҮҘпјҢеҫ—ж— ж°ҙNa2SO3еӣәдҪ“гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||
|
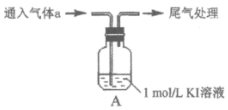
жҹҗе°Ҹз»„д»Ҙ4HпјӢпјӢ4IпјҚпјӢO2пјқ2I2пјӢ2H2Oдёәз ”з©¶еҜ№иұЎпјҢжҺўз©¶еҪұе“Қж°§еҢ–иҝҳеҺҹеҸҚеә”еӣ зҙ гҖӮ
пјҲ1пјүе®һйӘҢв…Јзҡ„дҪңз”ЁжҳҜ______________гҖӮз”ЁCCl4иҗғеҸ–в… гҖҒв…ЎгҖҒв…ўгҖҒв…Јзҡ„жә¶ж¶ІпјҢиҗғеҸ–еҗҺдёӢеұӮCCl4зҡ„йўңиүІеқҮж— жҳҺжҳҫеҸҳеҢ–гҖӮ пјҲ2пјүеҸ–иҗғеҸ–еҗҺдёҠеұӮжә¶ж¶ІпјҢз”Ёж·ҖзІүжЈҖйӘҢпјҡв… гҖҒв…ўзҡ„жә¶ж¶ІеҸҳи“қпјӣв…ЎгҖҒв…Јзҡ„жә¶ж¶ІжңӘеҸҳи“қгҖӮжә¶ж¶ІеҸҳи“қиҜҙжҳҺв… гҖҒв…ўдёӯз”ҹжҲҗдәҶ______________гҖӮ пјҲ3пјүжҹҘйҳ…иө„ж–ҷпјҡI2жҳ“жә¶дәҺKIжә¶ж¶ІгҖӮдёӢеҲ—е®һйӘҢиҜҒе®һдәҶиҜҘз»“и®ә并解йҮҠв… гҖҒв…ўзҡ„иҗғеҸ–зҺ°иұЎгҖӮ
зҺ°иұЎxжҳҜ______________гҖӮ пјҲ4пјүй’ҲеҜ№в…Ўдёӯжә¶ж¶ІжңӘжЈҖеҮәI2зҡ„еҺҹеӣ пјҢжҸҗеҮәдёүз§ҚеҒҮи®ҫпјҡ еҒҮи®ҫ1пјҡжә¶ж¶ІдёӯcпјҲHпјӢпјүиҫғе°ҸгҖӮе°Ҹз»„еҗҢеӯҰи®ӨдёәжӯӨеҒҮи®ҫдёҚжҲҗз«ӢпјҢдҫқжҚ®жҳҜ______________гҖӮ еҒҮи®ҫ2пјҡO2еҸӘж°§еҢ–дәҶSO2пјҢеҢ–еӯҰж–№зЁӢејҸжҳҜ______________гҖӮ еҒҮи®ҫ3пјҡI2дёҚиғҪеңЁжӯӨжә¶ж¶ІдёӯеӯҳеңЁгҖӮ пјҲ5пјүи®ҫи®ЎдёӢеҲ—е®һйӘҢпјҢйӘҢиҜҒдәҶеҒҮи®ҫ3пјҢ并继з»ӯжҺўз©¶еҪұе“Қж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„еӣ зҙ гҖӮ i.еҸ–в…Ўдёӯдә®й»„иүІжә¶ж¶ІпјҢж»ҙе…Ҙе“ҒзәўпјҢзәўиүІиӨӘеҺ»гҖӮ ii.еҸ–в…Ўдёӯдә®й»„иүІжә¶ж¶ІпјҢеҠ зғӯпјҢй»„иүІиӨӘеҺ»пјҢз»Ҹе“ҒзәўжЈҖйӘҢж— SO2гҖӮеҠ е…Ҙй…ёеҢ–зҡ„AgNO3жә¶ж¶ІпјҢдә§з”ҹеӨ§йҮҸAgIжІүж·ҖпјҢй•ҝж—¶й—ҙйқҷзҪ®пјҢжІүж·Җж— жҳҺжҳҫеҸҳеҢ–гҖӮ iii.еҸ–в…Ўдёӯдә®й»„иүІжә¶ж¶ІпјҢжҺ§еҲ¶дёҖе®ҡз”өеҺӢе’Ңж—¶й—ҙиҝӣиЎҢз”өи§ЈпјҢз»“жһңеҰӮдёӢгҖӮ
з»“еҗҲеҢ–еӯҰеҸҚеә”пјҢи§ЈйҮҠдёҠиЎЁдёӯзҡ„зҺ°иұЎпјҡ______________гҖӮ пјҲ6пјүз»јеҗҲе®һйӘҢиҜҒжҚ®иҜҙжҳҺеҪұе“ҚIпјҚиў«ж°§еҢ–зҡ„еӣ зҙ еҸҠеҜ№еә”е…ізі»______________гҖӮ
|
|||||||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
NH3еҸҜз”ЁдәҺз”ҹдә§зЎқй…ёе’Ңе°ҝзҙ гҖӮ пјҲ1пјүз”ҹдә§зЎқй…ёпјҡ в‘ NH3еӮ¬еҢ–ж°§еҢ–жҳҜе·ҘдёҡеҲ¶зЎқй…ёзҡ„第дёҖжӯҘеҸҚеә”пјҢе…¶еҢ–еӯҰж–№зЁӢејҸжҳҜ______________гҖӮ в‘ЎйҷӨжӯӨд№ӢеӨ–пјҢзӣёеҗҢжқЎд»¶дёӢиҝҳеҸҜиғҪеҸ‘з”ҹд»ҘдёӢеүҜеҸҚеә”пјҡ 4NH3пјҲgпјүпјӢ4O2пјҲgпјүпјқ2N2OпјҲgпјүпјӢ6H2OпјҲgпјүВ В В В В В В 4NH3пјҲgпјүпјӢ3O2пјҲgпјүпјқ2N2OпјҲgпјүпјӢ6H2OпјҲgпјүВ В В В В В В дёӨдёӘеүҜеҸҚеә”еңЁзҗҶи®әдёҠи¶ӢеҠҝеқҮеҫҲеӨ§пјҢдҪҶе®һйҷ…з”ҹдә§дёӯеҪұе“Қ并дёҚеӨ§пјҢеҺҹеӣ жҳҜ______________гҖӮ пјҲ2пјүз”ҹдә§е°ҝзҙ пјҡ в‘ е°ҝзҙ зҡ„еҗҲжҲҗеҲҶдёӨжӯҘиҝӣиЎҢпјӣ a.2NH3пјҲgпјүпјӢCO2пјҲgпјү b.NH2COONH4пјҲlпјү еҲҷжҖ»еҸҚеә”2NH3пјҲgпјүпјӢCO2пјҲgпјү в‘ЎдёӢеӣҫдёәnпјҲNH3пјүпјҡnпјҲCO2пјүпјқ4пјҡ1ж—¶пјҢжё©еәҰеҜ№CO2зҡ„иҪ¬еҢ–зҺҮзҡ„еҪұе“ҚгҖӮи§ЈйҮҠжё©еәҰеҚҮй«ҳCO2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮеўһеӨ§зҡ„еҺҹеӣ пјҡ______________гҖӮ
в‘ўжөӢе®ҡе°ҝзҙ ж ·е“Ғеҗ«ж°®йҮҸзҡ„ж–№жі•еҰӮдёӢпјҡеҸ–a gе°ҝзҙ ж ·е“ҒпјҢе°ҶжүҖеҗ«ж°®е®Ңе…ЁиҪ¬еҢ–дёәNH3пјҢжүҖеҫ—NH3з”ЁиҝҮйҮҸзҡ„v1 mL c1 molВ·LпјҚ1 H2SO4жә¶ж¶Іеҗёж”¶е®Ңе…ЁпјҢеү©дҪҷH2SO4з”Ёv2 mL c2 molВ·LпјҚ1 NaOHжә¶ж¶ІжҒ°еҘҪдёӯе’ҢпјҢеҲҷе°ҝзҙ ж ·е“Ғдёӯж°®е…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°жҳҜ______________гҖӮ
|
|
- иӢҸе·һж–°иҚүжЎҘдёӯеӯҰй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·еҲ·йўҳз»ғд№
- жұҹиҘҝзңҒиөЈе·һеёӮиөЈеҺҝ第дёүдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹ9жңҲе…ҘеӯҰиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- еј е®¶еҸЈз¬¬дёҖдёӯеӯҰй«ҳдәҢеҢ–еӯҰ2019е№ҙеҗҺеҚҠжңҹжңҲиҖғжөӢйӘҢйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- жІіеҢ—зңҒзҹіе®¶еә„еёӮ第дәҢдёӯеӯҰ2020еұҠй«ҳдёӯжҜ•дёҡзҸӯдёүжңҲд»ҪзҪ‘з»ңж•ҷеӯҰиҙЁйҮҸзӣ‘жөӢеҚ·зҗҶ科综еҗҲеҢ–еӯҰйғЁеҲҶ
- 2018-2019е№ҙй«ҳдәҢдёҠеӯҰжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲдә‘еҚ—зңҒзҺүжәӘеёӮ第дёҖдёӯеӯҰпјү
- иЎЎж°ҙеёӮ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢиҜ•еҚ·е®Ңж•ҙзүҲ
- иҫҪе®ҒзңҒе®һйӘҢдёӯеӯҰ2021еұҠй«ҳдёүдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№
- й»‘йҫҷжұҹй«ҳдёүеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙдёҠеҚҠе№ҙпјүиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ