山西省晋中市2021年高考化学三模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
经过202天的飞行,2021年2月10日19时52分,“天问一号”成功“刹车”,成为我国第一颗人造火星卫星。下列关于“天问一号”的化工材料叙述正确的是( )
A . 探测器的结构材料大多采用高强度的不锈钢
B . 火星车温控涂层材料聚酰胺薄膜属于合成有机高分子材料
C . 太阳能电池用于导电元件的主要成分为二氧化硅
D . 制造大型抛物面天线的铝合金或玻璃钢均为金属材料
|
|
| 2. 单选题 | |
|
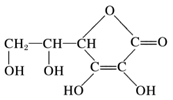
维生素C对人体健康有很重要的作用,能治疗或辅助治疗多种疾病,其结构简式如图所示。下列关于维生素C的说法错误的是( )
A . 维生素C分子中五元环上的碳原子一定共平面
B . 维生素C能使难以被人体吸收的Fe3+还原为易于被人体吸收的Fe2+
C . 维生素C既能与金属钠反应,又能与氢氧化钠溶液反应
D . 维生素C的同分异构体中可能存在芳香族化合物
|
|
| 3. 单选题 | |
|
废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述错误的是( )
A . “溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O
B . “溶解”操作中的空气可以用双氧水代替
C . “调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2
D . “过滤II”所得滤渣只需洗涤,无需干燥
|
|
| 4. 单选题 | |
|
合成氨的化学反应为N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是( ) 2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是( )
A . 铁是该合成氨反应的催化剂
B . 采用该方案生产氨气,活化能不变
C . 采用该方案生产氨气,△H不变
D . 该方案氨的含量高,与反应温度较低有关
|
|
| 5. 单选题 | |
|
寿山石是中华瑰宝,传统“四大印章石”之一,品种达数+种之多。某地采掘的寿山石主要由酸性火山凝灰岩经热液蚀变而成,化学式为X2Y4Z10(ZW)2。已知X、Y、Z、W均为短周期元素,X元素原子的最外层电子数等于其电子层数,且其单质能与强碱反应生成W2 , YW4与W2Z2含有相同的电子数。下列说法错误的是( )
A . 原子半径:X>Y>Z>W
B . X的氧化物可用作冶炼单质X的原料
C . Y元素主要以游离态存在于自然界
D . 常温、常压下,Z和W形成的常见化合物均为液体
|
|
| 6. 单选题 | |
|
利用原电池原理,各种化学电池应运而生。某单液二次电池(如图所示),其反应原理为H2+2AgCl
 2Ag+2HCl。下列说法正确的是( ) 2Ag+2HCl。下列说法正确的是( )
A . 放电时,正极的电极反应为Ag++e-=Ag
B . 放电时,电子从左边电极经溶液移向右边电极
C . 充电时,右边电极与电源的正极相连
D . 充电时,每生成1 mol H2 , 溶液质量增加216 g
|
|
| 7. 单选题 | |
|
常温下,将0.01 mol·L-1的盐酸逐滴加入到10 mL 0.01 mol·L-1 NaA溶液中。滴加过程中,A-、HA浓度所占分数(δ)随pH变化的关系如图甲所示[其中a点的坐标为(9.5,0.5)],pH变化曲线如图乙所示。下列溶液中的关系一定正确的是( )
A . 当c(Cl-)=c(HA)时,溶液的pH=7
B . 常温下NaA的水解平衡常数:Kh(NaA)=10-9.5
C . b点溶液中阴离子浓度:c(A-)>c(Cl-)>c(OH-)
D . c点溶液中:c(A-)+c(HA)=0.01mol·L-1
|
|
| 8. 综合题 | |
|
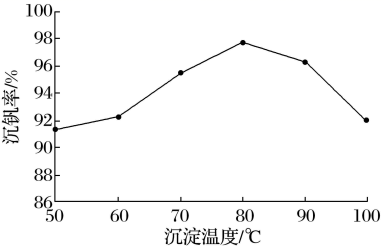
五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收五氧化二钒和硫酸钾,既能避免环境污染,又能节约资源。回收工艺流程如下:
已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO ②有机萃取剂萃取VO2+的能力比萃取VO ③溶液中VO
|
|
| 9. 实验探究题 | |
|
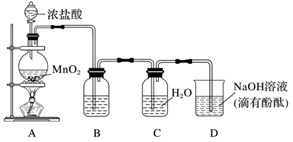
作为广泛使用的抑菌类产品原料,有关氯气的研究越来越受到重视。某研究性学习小组用如图装置制备氯气并对氯气及其化合物的性质进行实验探究。
|
|
| 10. 综合题 | |
|
李克强总理在十三届全国人民代表大会第四次会议上作政府工作报告时指出:优化产业结构和能源结构,扎实做好碳达峰、碳中和各项工作。碳中和是指一个组织在一年内的二氧化碳排放通过二氧化碳去除技术达到平衡。
|
|
- 江苏省扬州市2020年高考化学6月试卷
- 2015-2016学年湖南省衡阳市衡阳县四中高二下学期期中化学试卷
- 2017年山西省吕梁市孝义市高考化学考前热身试卷 ,
- 吉林省吉林市蛟河市第一中学2019-2020学年高二上学期化学期中考试试卷
- 人教版化学高二选修5第二章第一节脂肪烃同步练习
- 浙江省宁波十校2019-2020学年高三下学期化学3月月考试卷
- 湖北省黄冈市2016-2017学年高一上学期化学期末考试试卷
- 2015-2016学年湖南省常德市汇文中学高二下学期期中化学试卷
- 广东省茂名市2020年高考理综-化学一模试卷
- 广西钦州市2015-2016学年高一下学期化学期末考试试卷
- 2015-2016学年山东省德州市武城二中高一下学期期中化学试卷
- 江苏省扬州市宝应县安宜高级中学2016-2017学年高二上学期化学期中考试试卷(选修)




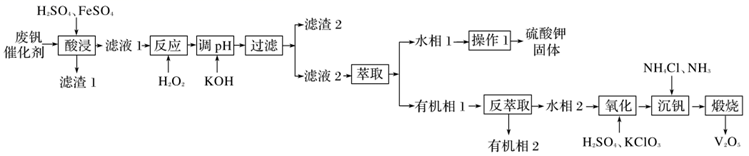
 和VO2+。
和VO2+。 可相互转化:VO
可相互转化:VO