广东省江门市2017-2018学年高三理综-化学模拟考试试卷
广东省江门市2017-2018学年高三理综-化学模拟考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活密切相关,下列说法错误的是()
A . 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B . 加热能杀菌消毒是因为蛋白质受热变性
C . 细铁粉具有还原性可作食品抗氧剂
D . 草木纤维和大米淀粉遇碘水均显蓝色
|
|
| 2. 单选题 | |
|
中国诗词、成语中还蕴含着许多化学知识。下列分析正确的是( )
A . “榆荚只能随柳絮,等闲缭乱走空园”中“柳絮”的主要成分为蛋白质
B . “纷纷灿烂如星陨,赫赫喧豗似火攻”灿烂美丽的烟花是某些金属的焰色反应,属于化学变化
C . “百炼成钢”,通过多次锻炼,使生铁中碳等杂质降低达到了钢的标准
D . 海市蜃楼这种光学现象,与胶体知识无关
|
|
| 3. 单选题 | |
|
关于有机物a(
A . a、b互为同分异构体
B . b、c互为同系物
C . c分子的所有原子不可能在同一平面上
D . a、b、c均能与溴水反应
|
|
| 4. 单选题 | |
|
实验室在500℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4 , 气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )
A . 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B . 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C . 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
D . 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
|
|
| 5. 单选题 | |
|
硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS
 Na2Sx。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是( ) Na2Sx。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是( ) 
A . 硫钠电池放电时负极反应为:Na-e-=Na+
B . 硫钠电池充电时,每生成1molNa转移xmol电子
C . 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D . 合成氨过程中H+经质子交换膜由a极向b极迁移
|
|
| 6. 单选题 | |
|
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中正确的是()
A . X位于元素周期表中第二周期第IA族
B . X的单质和Y的单质相比,熔点较高的是X
C . Z的氧化物的水化物一定是强酸
D . W、X可形成X2W、X2W2离子化合物,且阴阳离子个数比均为1:2
|
|
| 7. 单选题 | |
|
常温下0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数随pH变化的关系如图所示.下列表述正确的是( )
A . 在含H2A、HA-、A2-的溶液中,通入少量HCl,HA-的物质的量分数一定变大
B . 将等物质的量的NaH A、Na2A溶于水中,所得溶液中存在:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
C . 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D . 将等物质的量的NaHA,Na2A溶于水中,所得溶液pH恰好为4.2
|
|
| 8. 实验探究题 | ||||||||||||||||
|
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2 , 部分装置如图所示,回答以下问题:
|
||||||||||||||||
| 9. 综合题 | |
|
钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2 , 含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
|
|
| 10. 综合题 | |
|
废弃物的回收利用可实现资源再生,并减少污染.
|
|
高中化学 试卷推荐
- 第7讲:铁及其化合物
- 2016-2017学年辽宁省葫芦岛市六校协作体高一上学期期中化学试卷
- 2015-2016学年陕西省汉中市汉台中学高一下学期期中化学试卷
- 备考2018年高考化学二轮专题复习 综合复习:有机化学
- 山西运城市2020年高考化学一模试卷
- 2020年山东省高考化学试卷(新高考I)
- 人教版化学高二选修6第四单元实验4-3含氯消毒液性质、作用的探究同步练习
- 浙江省衢州市2019-2020学年高一下学期化学期末考试试卷
- 2015-2016学年四川省眉山中学高二下学期期中化学试卷
- 2017_2018学年高中化学人教版选修四 第四章电化学基础4.3.1电解池
- 2015-2016学年河北省邯郸市曲周一中高二下学期期末化学试卷
- 山东省烟台市2017-2018学年高一下学期化学期末考试试卷
最近更新








 固体
固体



 MoO3+SO2 , 该反应中氧化产物是(填化学式)
MoO3+SO2 , 该反应中氧化产物是(填化学式)
 O2(g)═H2O(l)△H=-285kJ•mol-1
O2(g)═H2O(l)△H=-285kJ•mol-1 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,  = mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
= mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)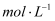 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量  气体,使
气体,使  完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的 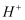 浓度是
浓度是 





