辽宁省抚顺市2020年高考化学二模试卷
辽宁省抚顺市2020年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是( )
A . 蛋白质和核酸均是高分子化合物
B . 蛋白质中含C,H,O,N 等元素
C . 五碳糖( C5H10O5)与葡萄糖互为同系物
D . NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 50 g 34%H2O2溶液中含H-O键的数目为NA
B . 180 g淀粉完全水解生成葡萄糖的分子数为NA
C . 1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D . 反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
|
|
| 3. 单选题 | |
|
下列指定反应的离子方程式书写正确的是( )
A . NO2通入NaOH浓溶液中:2NO2+2OH-=NO
 +NO +NO  +H2O
B . (CH3COO)2Pb溶液中滴入稀硫酸:Pb2++SO +H2O
B . (CH3COO)2Pb溶液中滴入稀硫酸:Pb2++SO 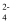 =PbSO4↓
C . NaAlO2溶液中加入少量盐酸:AlO =PbSO4↓
C . NaAlO2溶液中加入少量盐酸:AlO  +4H+=Al3++2H2O
D . NH4HSO3溶液中加入少量Ba(OH)2溶液:HSO +4H+=Al3++2H2O
D . NH4HSO3溶液中加入少量Ba(OH)2溶液:HSO  +Ba2++OH-=BaSO3↓+H2O +Ba2++OH-=BaSO3↓+H2O
|
|
| 4. 单选题 | |
|
苯胺为无色液体,还原性强,易被氧化,有碱性,与酸反应生成盐,硝基苯与氢气制备苯胺(沸点为184℃)的反应原理如下:
某同学设计的制备实验装置(部分夹持装置省略)如图: 下列说法正确的是( )
A . 仅用上述装置图中仪器就可以完成该实验
B . 用硝酸代替盐酸,反应速率更快,实验效果较好
C . 点燃酒精灯前,打开K,先通一段时间的H2
D . 三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入浓硫酸后蒸馏
|
|
| 5. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W、X、Y的最外层电子数之和与Z的最外层电子数相等,Y的族序数等于其周期数。下列说法错误的是( )
A . 四种元素形成的单质中,Z的单质沸点最低
B . WZ3中W满足8电子稳定结构
C . Y、Z形成的化合物的水溶液呈酸性
D . X的氧化物可能既含离子键又含共价键
|
|
| 6. 单选题 | |
|
一种钾离子电池的工作原理如图所示,下列说法正确的是( )
A . 放电时,负极的电极反应式 :KC6 –e- =K ++6C
B . 充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C . 放电时,K+ 通过阳离子交换膜向石墨电极移动
D . 若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
|
|
| 7. 单选题 | |
|
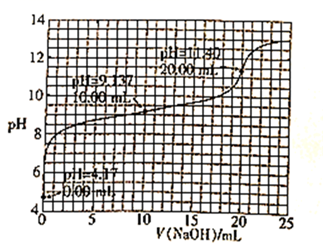
已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
下列说法正确的是( )
A . 可用酚酞作滴定指示剂
B . 起始时H3BO3的浓度为0.8mol·L-1
C . H3BO3的电离常数数量级为10-5
D . 滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
|
|
| 8. 综合题 | |
|
Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2 , 还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
回答下列问题:
|
|
| 9. 实验探究题 | |
|
H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
回答下列问题:
|
|
| 10. 综合题 | |
|
CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g) Ⅱ.2CH3OH(g) Ⅲ.CO2(g)+H2(g) Ⅳ.2CO2(g)+6H2(g) 回答下列问题:
|
|
高中化学 试卷推荐
- 黑龙江省齐齐哈尔市2018-2019学年高考理综-化学一模考试试卷
- 福建省南平市2019-2020学年高一下学期化学期末考试试卷
- 2015-2016学年辽宁省营口市大石桥二中高二下学期期中化学试卷
- 2015-2016学年福建省南平市浦城县高一下学期期中化学试卷
- 2015-2016学年广西崇左市大新县民族高中高一上学期第一次月考化学试卷
- 2015-2016学年江苏省盐城市时杨中学高二下学期期中化学试卷
- 人教版化学高二选修6第四单元实验4-1纯净物与混合物性质的比较同步练习
- 广西南宁市“4N”高中联合体2018-2019学年高二下学期化学期末考试试卷
- 专题27:有机高分子材料
- 2016年江西省宜春市宜丰二中高考化学五模试卷
- 四川省绵阳市2019-2020学年高一下学期化学期末考试试卷
- 备考2018年高考化学二轮专题复习 专题十二:有机化合物
最近更新

 +3H2
+3H2 
 +2H2O
+2H2O


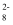 被还原为SO
被还原为SO 
 CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
 ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。 



