湖南省益阳市2017-2018学年高考理综-化学4月模拟考试试卷
湖南省益阳市2017-2018学年高考理综-化学4月模拟考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
人类的生活、生产离不开化学。下列说法正确的是( )
A . 市售苏打水的pH约为7
B . 维生素C能使Fe2+转化为Fe3+
C . 光导纤维的导电性能优于铜
D . 硫酸钡常用于X射线造影剂
|
|
| 2. 单选题 | |
|
用0.0100mol/L的KMnO4标准溶液滴定某未知浓度的H2C2O4溶液,下列说法错误的是( )
A . 该滴定实验不需要指示剂
B . 该实验用到的玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶
C . 滴定管使用前需检验是否漏液
D . 若滴定终止时,仰视读数,所测H2C2O4浓度偏高
|
|
| 3. 单选题 | |
|
富瓦烯类化合物甲、乙、丙的结构简式如图所示,下列说法正确的是( )
A . 甲与丙互为同系物
B . 乙与丙互为同分异构体
C . 甲的一溴代物种数少于丙
D . 三者各1mol时,消耗Br2的物质的量相等
|
|
| 4. 单选题 | |
|
某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。下列说法错误的是( )
A . a、b、c中依次盛装70%硫酸.Na2SO3固体、NaOH溶液
B . 实验时,湿润的pH试纸、鲜花、品红溶液、KMnO4溶液均褪色,Na2S溶液出现淡黄色沉淀
C . 此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性
D . 点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使KMnO4溶液褪色不具有可逆性
|
|
| 5. 单选题 | |
|
锌-铈液流电池体系作为氧化还原液流电池中的新生一代,有着诸多的优势,如开路电位高、污染小等。锌-铈液流电池放电时的工作原理如图所示,其中,电极为惰性材料,不参与电极反应。下列有关说法正确的是( )
A . 放电时,电池的总反应式为2Ce4++Zn=Zn2++2Ce3+
B . 充电时,a极发生氧化反应,b极发生还原反应
C . 充电时,当电路中通过0.1mol电子时,b极增加14g
D . 选择性离子膜为阴离子交换膜,能阻止阳离子通过
|
|
| 6. 单选题 | |
|
A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法错误的是( )
A . 乙分子中共用电子对数目与B2分子相同
B . 单质D与E在加热时可生成1:1型化合物
C . 原子半径:B>C
D . C与D位于同一主族,与B位于同一周期
|
|
| 7. 单选题 | |
|
常温下,Ka(CH3COOH)=1.8×10-5 , 分别向20mL0.1mol/LNaHCO3溶液和CH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,滴定曲线如图所示,下列叙述正确的是( )

A . a点溶液中存在:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B . b、d点溶液中离子浓度的大小关系均为c(Na+)3COO-)
C . C点溶液中存在:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
D . d点溶液中: n(CH3COO-)/n(CH3COOH)=180
|
|
| 8. 实验探究题 | |
|
纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3.
请回答下列问题:
|
|
| 9. 实验探究题 | ||||||||||||||||
|
金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好: Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
回答下列问题:
|
||||||||||||||||
| 10. 综合题 | |
|
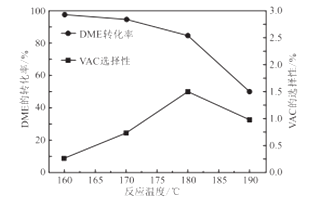
醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
|
|
高中化学 试卷推荐
- 江苏省宿迁市2017-2018学年高一上学期化学期末考试试卷
- 高中化学人教版(2019)必修第一册 第一章单元测试
- 湖南省张家界市2018-2019学年高一上学期化学期末考试试卷
- 湖北省十堰市2019-2020学年高二下学期化学期末考试试卷
- 2015-2016学年江苏省南通市如皋市高一下学期期中化学试卷
- 人教版高中化学选修五 第一章第三节:有机化合物的命名
- 2016-2017学年四川省绵阳市丰谷中学高二上学期开学化学试卷
- 2019年初中化学中考难点专练 16 无机化工流程
- 福建省三明市2019-2020学年高一下学期化学期末考试试卷
- 2019年高考化学真题分类汇编专题07:化学平衡
- 江苏省南京师范大学附属中学2020年高考化学6月模拟试卷
- 浙江省嘉兴市2019-2020学年高二下学期化学期末考试试卷
最近更新





 ;b
;b 

 CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。  )的影响,该反应的ΔH0(填“>”“<”或“=”);控制的最佳温度是.
)的影响,该反应的ΔH0(填“>”“<”或“=”);控制的最佳温度是.