安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题
安徽省“皖南八校”2022届高三下学期第三次联考理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | ||||||||||||||||
|
三星堆遗址被誉为20世纪人类最伟大的考古发现之一。下列叙述错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 2. 单选题 | ||||||||||||||||
|
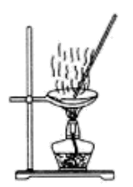
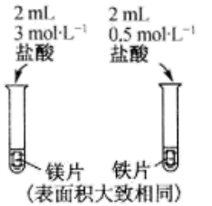
用下列实验装置进行相应实验,能达到实验目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 3. 单选题 | |
|
设NA是阿伏加德罗常数的值。生物法(加入脱硫细菌)净化含硫物质时发生如下反应:CH3COOH+Na2SO4=2NaHCO3+H2S↑。下列说法错误的是( )
A . 30gCH3COOH和HCHO混合物中含有的碳原子数目为NA
B . 生成标准状况下2.24LH2S气体,转移的电子数为0.8NA
C . 1L0.1mol·L-1NaHCO3溶液中,含有
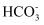 、 、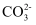 的数目和为0.1NA
D . 常温常压下,3.4gH2S气体中含有的电子数为1.8NA 的数目和为0.1NA
D . 常温常压下,3.4gH2S气体中含有的电子数为1.8NA
|
|
| 4. 单选题 | |
|
作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是( )
A . 鲁米诺的化学式为C8H6N3O2
B . 1molA最多可以和2molNaHCO3反应
C . B中处于同一平面的原子最多12个
D . (1)(2)两步的反应类型分别为加成反应和取代反应
|
|
| 5. 单选题 | |
|
R、X、Y、Z是四种元素周期表中前20号元素,且原子序数依次增大,“毅力”号火星车收集的岩石成分之一是ZYR3 , 地壳中含有大量的粒子
A . 原子半径:Z>Y>X>R
B . 简单的氢化物稳定性:X>R>Y
C . ZR2只含一种化学键
D . 单质的导电性:Y>Z
|
|
| 6. 单选题 | |
|
光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法的不合理的是( )
A . 该装置工作时涉及光能、化学能及电能的转化
B . 光照过程中阳极区溶液中的n(OH-)基本不变
C . 再生池中的反应为2V2++2H+
 2V3++H2↑
D . 阳极生成1molO2时,理论上双极膜共解离出离子数4NA个 2V3++H2↑
D . 阳极生成1molO2时,理论上双极膜共解离出离子数4NA个
|
|
| 7. 单选题 | |
|
常温下,已知弱酸
 溶液中含R物种的浓度之和为 溶液中含R物种的浓度之和为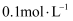 , 溶液中所有含R物种的 , 溶液中所有含R物种的 的关系如图所示,下列说法错误的是( ) 的关系如图所示,下列说法错误的是( )
已知,①pOH表示 ②a、b、c三点的坐标,a(7.3,-1.3)、b(10.0.-3.6)、c(12.6,-1.3)。
A .
 为二元弱酸
B . 曲线③表示 为二元弱酸
B . 曲线③表示 随pOH的变化
C . pH=6.7的溶液中: 随pOH的变化
C . pH=6.7的溶液中: D . 反应
D . 反应 的平衡常数 的平衡常数
|
|
| 8. 实验探究题 | |
|
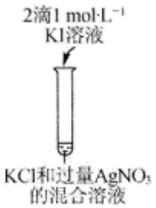
纯ClO2遇热易发生分解,工业上通常制成NaClO2固体以便运输和储存。制备NaClO2的实验装置如图所示(夹持装置省略),其中A装置制备ClO2 , C装置用于制备NaClO2。回答下列问题:
|
|
| 9. 综合题 | |
|
稀土元素在耐热钢中有重要的作用。某废渣含Eu2O3、Fe2O3、Al2O3、Ta2O5、MnO等物质。以此废渣为原料,设计如下工艺流程对资源进行回收,可得到较为纯净的TaCl5(氯化钽)和Eu2O3(氧化铕)。
回答下列问题:
|
|
| 10. 综合题 | |
|
我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应I生产甲醇,同时伴有反应II发生。
I.CO2(g)+3H2(g) II.CO2(g)+H2(g) 回答下列问题:
|
|
最近更新




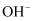 浓度的负对数[
浓度的负对数[ ]。
]。
 对粗产品中NaClO2含量的影响如图所示。则最佳条件为c(NaOH)=mol·L-1 ,
对粗产品中NaClO2含量的影响如图所示。则最佳条件为c(NaOH)=mol·L-1 , 
 +4I-+4H+=2H2O+2I2+Cl- , 将所得混合液稀释成250 mL待测溶液。移取25.00 mL待测溶液,用0.8000 mol·L-1的Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的体积平均值为20.0 mL(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl- , 将所得混合液稀释成250 mL待测溶液。移取25.00 mL待测溶液,用0.8000 mol·L-1的Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的体积平均值为20.0 mL(已知:I2+2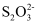 =2I-+
=2I-+ )。则该样品中NaClO2的质量分数为。
)。则该样品中NaClO2的质量分数为。



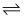 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1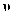 正=k正·c(CO2)·c3(H2),逆反应速率可表示为
正=k正·c(CO2)·c3(H2),逆反应速率可表示为

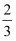 (选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=MPa-2(分压=总压×物质的量分数)。
(选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=MPa-2(分压=总压×物质的量分数)。


