四川省成都市南开为明学校2020-2021学年高三上学期化学9月月考试卷
四川省成都市南开为明学校2020-2021学年高三上学期化学9月月考试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
《天工开物》记载古代四川“井火取盐”的过程:“临邛(地名)火井(废井,废气遇明火可燃)一所,纵广五尺,深二三丈”“取井火还煮井水”“一水得四五斗盐”,“井火”燃烧的物质是( )
A . 天然气
B . 煤炭
C . 石油
D . 石蜡
|
|
| 2. 单选题 | ||||||||||||||||
|
化学与社会、生活密切相关。对下列现象或事实的解释错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 3. 单选题 | |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1mol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B . 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C . 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
D . 27g铝中加入1L 1 mol/L
|
|
| 4. 单选题 | |
|
最近英国研究人员创造了一种由18个碳原子构成的环碳(cyclocarbon)分子(如图)。下列有关说法错误的是( )
A . 与石墨互为同素异形体
B . 是一种新型共价化合物
C . 在加热条件下能与浓硝酸反应
D . 分子中碳原子均达8电子稳定结构
|
|
| 5. 单选题 | |
|
化合物W(
A . W、M、N的一氯代物数目相等
B . W、M、N分子中的碳原子均共面
C . W、M、N均能与溴水发生加成反应
D . W、M、N均能使酸性KMnO4溶液褪色
|
|
| 6. 单选题 | |||||||||||||
|
下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||
| 7. 单选题 | |
|
短周期元素A、B、C、D、E的原子序数依次增大;A的最高价氧化物与B的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应;C、D为金属元素,且D原子最外层电子数等于其K层电子数,而C的阳离子半径大于D的阳离子;若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色。下列说法中正确的是( )
A . 金属D能在A的最高价氧化物中燃烧,生成A的化合物
B . B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键
C . C在元素周期表中的位置是第三周期第ⅠA族
D . E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性
|
|
| 8. 综合题 | |
|
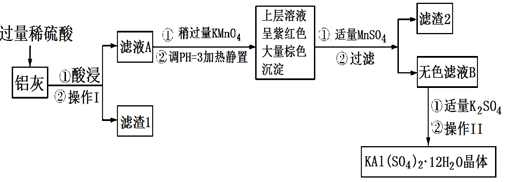
明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
|
|
| 9. 实验探究题 | |
|
某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入4mL 0.5mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
|
|
| 10. 实验探究题 | |
|
水合肼(N2H4·H2O)又名水合联氨,是无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
|
|
高中化学 试卷推荐
- 2016-2017学年山东省潍坊市昌乐及第中学高三上学期期中化学试卷(二)
- 人教版高中化学选修五 第四章第一节:油脂
- 江苏省苏州市苏大附中2017-2018学年高一上学期化学期末考试试卷
- 陕西省咸阳市2020年高考理综-化学三模试卷
- 2016-2017学年云南省保山市腾冲八中高二上学期期末化学试卷
- 辽宁省锦州市经济技术开发区(滨海新区)2019年高考化学模拟卷
- 广东省惠州市2017-2018学年高二上学期(理科)理综-化学期末考试试卷
- 2017-2018学年新人教版必修二高中化学第三章有机化合物3.2.2苯
- 陕西省咸阳市乾县第二中学2019-2020学年高一下学期化学期中考试试卷
- 天津市红桥区2020年高考化学一模试卷
- 福建省师范大学附属中学2017-2018学年高一下学期化学期末考试试卷
- 2016年江西省新余市分宜县高考化学五模试卷
最近更新